摘要:12.已知:Fe+2HCl==FeCl2+H2 ↑, 4HCI(浓)+MnO2==MnCl2+ Cl2↑+2H20.试判断以下关于盐酸性质的叙述中正确的是 A.有酸性和氧化性,无还原性 B.有酸性.氧化性和还原性 C.有酸性.还原性,无氧化性 D.有氧化性和还原性,无酸性
网址:http://m.1010jiajiao.com/timu3_id_168419[举报]
硝酸和浓硫酸是氧化性酸,盐酸是一种非氧化性酸。已知:Fe+2HCl=FeCl2+H2↑,MnO2+4HCl=MnCl2+2H2O+Cl2↑。试判断以下关于盐酸的性质的叙述中正确的是( )
A.有酸性和氧化性,无还原性
B.有酸性、氧化性和还原性
C.有酸性、还原性,无氧化性
D.盐酸是非氧化性酸,在化学反应中不可能表现氧化性
查看习题详情和答案>>中国尿素合成塔(尿塔)使用寿命仅为欧美国家的
.为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理:
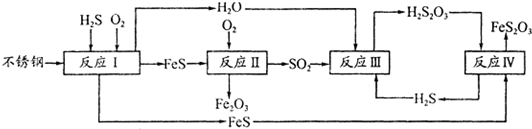
(1)H2S来自合成尿素的天然气.在380K、体积为2L的密闭容器中,存在如下反应:H2(g)+S(s)?H2S(g)△H═+21.5kJ/mol.反应达到平衡时H2、S、H2 S的物质的量均为3mol,则380K时该反应的化学平衡常数为 ;下列对该反应分析正确的是 (填字母序号).
(2)在反应I中发生的化学反应为 .
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负极为 ;
已知:Fe(s)+S(s)═FeS(s)△H1═-2.5akJ/mol;S(s)+O2(g)═SO2(g)△H2═-5akJ/mol9;
4Fe(s)+3O2(g)═2Fe2O3(s)△H3═-6akJ/mol?则反应II的热化学方程式为
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2.Na2S2O3水溶液呈 性,该 溶液中电荷守恒式为 ;反应IY的反应类型为 ;该反应 (填“能”或“不能”) 说明FeS溶解性强于FeS2O3
(5)泸天化尿塔的最终腐蚀产物为 ;为了有效防腐,北钢建议泸天化在生产中用 CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为 .
查看习题详情和答案>>
| 1 | 4 |

(1)H2S来自合成尿素的天然气.在380K、体积为2L的密闭容器中,存在如下反应:H2(g)+S(s)?H2S(g)△H═+21.5kJ/mol.反应达到平衡时H2、S、H2 S的物质的量均为3mol,则380K时该反应的化学平衡常数为

(2)在反应I中发生的化学反应为
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负极为
已知:Fe(s)+S(s)═FeS(s)△H1═-2.5akJ/mol;S(s)+O2(g)═SO2(g)△H2═-5akJ/mol9;
4Fe(s)+3O2(g)═2Fe2O3(s)△H3═-6akJ/mol?则反应II的热化学方程式为
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2.Na2S2O3水溶液呈
(5)泸天化尿塔的最终腐蚀产物为
(2013?德州二模)化学反应原理在工业生产中具有十分重要的意义.
(1)合成氨用的氢气有多种制取方法:请你写出用C制备水煤气的化学反应方程式
CO+3H2;比较以上两种方法转移6mol电子时,C和CH4的质量之比是
(2)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下: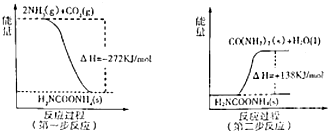
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为
(3)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=αkJ?mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K=
,a
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器容积 B.增加Fe的物质的量 C.升高温度到900℃D.使用合适的催化剂.
查看习题详情和答案>>
(1)合成氨用的氢气有多种制取方法:请你写出用C制备水煤气的化学反应方程式
C+H2O
CO↑+H2↑
| ||
C+H2O
CO↑+H2↑
.还可以由天然气或重油制取氢气:CH4+H2O(g)
| ||
| ||
| 催化剂 |
9:4
9:4
.(2)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为
2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ?mol-1
2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ?mol-1
.(3)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=αkJ?mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| C(CO2) |
| c(CO) |
| C(CO2) |
>
>
0(填“>”、“<”或“:”).在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4mol,则5min后达到平街时CO2的转化率为50%
50%
,生成CO的平均速率v(CO)为0.2mol/(Lmin)
0.2mol/(Lmin)
.②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
C
C
(填字母).A.缩小反应器容积 B.增加Fe的物质的量 C.升高温度到900℃D.使用合适的催化剂.
(2013?绍兴一模)工业催化剂K3[Fe(C2O4)3]?3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O.实验室由草酸亚铁晶体(FeC2O4?2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备.
请回答下列问题:
(1)写出H2O2的电子式
 ;[Fe(C2O4)3]3-的名称是
;[Fe(C2O4)3]3-的名称是
(2)配平以下总反应方程式:
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3?[Cu(NH3)4]2+,其稳定常数表达式为k=
.已知K[Fe(C2O4)3]3-=1020,K[Fe(SCN)3]=2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]?3H2O中的铁元素?
(5)铁元素可以形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂.经组成分析A中仅含K、Fe、C、N四种元素.取36.8gA加热至400℃,分解成KCN、Fe3C、C、N2,生成的氮气折合成标准状况下的体积为2.24L,Fe3C质量是C质量的3倍.Fe3C的物质的量是氮气物质的量的
.则A的化学式为
查看习题详情和答案>>
请回答下列问题:
(1)写出H2O2的电子式


[Fe(C2O4)3]3-为络离子,名称为三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根)
[Fe(C2O4)3]3-为络离子,名称为三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根)
.(2)配平以下总反应方程式:
2
2
FeC2O4?2H2O+1
1
H2O2+3
3
K2C2O4+1
1
H2C2O4=3
3
K3[Fe(C2O4)3]?3H2O(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式
H2C2O4+H2O2=2CO2↑+2H2O
H2C2O4+H2O2=2CO2↑+2H2O
.(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3?[Cu(NH3)4]2+,其稳定常数表达式为k=
c[Cu(NH3
| ||
| c(Cu2+)?c4(NH3) |
否
否
(填“是”“否”)若选“否”,请设计检验铁元素的方案取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无
取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无
.(5)铁元素可以形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂.经组成分析A中仅含K、Fe、C、N四种元素.取36.8gA加热至400℃,分解成KCN、Fe3C、C、N2,生成的氮气折合成标准状况下的体积为2.24L,Fe3C质量是C质量的3倍.Fe3C的物质的量是氮气物质的量的
| 1 |
| 3 |
K4Fe(CN)6
K4Fe(CN)6
. (1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,则甲烷燃烧热的热化学方为
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,则甲烷燃烧热的热化学方为CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890KJ/mol
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890KJ/mol
.(2)已知:Fe(s)+1/2O2(g)=FeO(s)△H=-270.0kJ/mol,2Al(s)+3/2O2(g)=Al2O3(s)△H=-1675.7kJ/mol,Al和FeO发生铝热反应的热化学方程式是
2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-865.7 kJ?mol-1
2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-865.7 kJ?mol-1
.(3)①反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是
BC
BC
(填序号)A.铁片与稀盐酸反应
B.灼热的碳与CO2反应
C.Ba(OH)2?8H2O与NH4Cl反应
D.甲烷在氧气中的燃烧反应
②煤作为燃料有两种途径:
Ⅰ、C(s)+O2(g)═CO2(g)△H1<0Ⅱ.C(s)+H2O(g)═CO(g)+H2(g)△H2>0
2CO(g)+O2(g)═2CO2(g)△H3<0 2H2(g)+O2(g)═2H2O(g)△H4<0
请回答:途径Ⅰ放出的热量
=
=
途径Ⅱ放出的热量(填“>”、“<”或“=”).△H1、△H2、△H3、△H4之间关系的数学表达式是
△H1=△H2+
(△H3+△H4)
| 1 |
| 2 |
△H1=△H2+
(△H3+△H4)
.| 1 |
| 2 |