网址:http://m.1010jiajiao.com/timu3_id_168234[举报]
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。

(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。

(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3•3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
查看习题详情和答案>>
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。
(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。
(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。

(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。
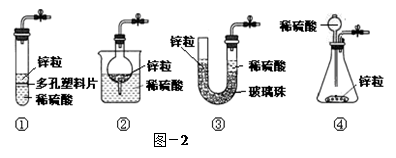
(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
请从给出的3道化学题中任选一题做答
1.[化学——选修化学与技术]
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k__________(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中X、Y分别是_________、_________(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应
正极:_________;负极:_________;
③这样设计的主要节(电)能之处在于(写出2处)
___________________________、___________________________。
2.[化学——选修物质结构与性质]
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为_________,该元素的符号为_________;
(2)Y元素原子的价层电子的轨道表示式为_________,该元素的名称是_________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由____________________________________。
3.[化学——选修有机化学基础]
A~J均为有机化合物,它们之间的转化如下图所示:

实验表明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1∶1∶1;
③G能使溴的四氯化碳溶液褪色;
④1 mol J与足量金属钠反应可放出22.4 L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为_________(不考虑立体异构),由A生成B的反应类型是_________反应;
(2)D的结构简式为___________________________;
(3)由E生成F的化学方程式为____________,E中的官能团有____________(填名称),与E具有相同官能团的E的同分异构体还有____________(写出结构简式,不考虑立体异构);
(4)G的结构简式为____________________________________;
(5)由I生成J的化学方程式为________________________。
查看习题详情和答案>>| A、钠与水反应:用镊子从煤油中取出金属钠,切下绿豆大小的钠, 小心放入装满水的烧杯中 | B、制备并检验氢气的可燃性:锌粒与稀硫酸反应产生气体,立即点燃 | C、用浓硫酸制稀硫酸:把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃棒不断搅拌 | D、一氧化碳还原氧化铜:用石灰水检验气体产物,实验结束时先从水槽中取出导管,再熄灭酒精灯 |