摘要:7.注意FeCl3.Fe2(SO4)3的水溶液蒸干所得剩余固体的区别. FeCl3溶液加热浓缩时.因Fe3+水解和HCl的挥发.得到的固体为Fe(OH)3.如灼烧后得到红色的Fe2O3固体.但Fe2(SO4)3溶液蒸干时.因硫酸是难挥发性酸.将不能得到Fe(OH)3固体.
网址:http://m.1010jiajiao.com/timu3_id_167809[举报]
学习化学应该明确“从生活中来,到生活中去”道理.在生产生活中,我们会遇到各种各样的化学反应.请你写出下列反应的化学方程式.(注意反应条件并配平)
(1)已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电板
(2)玻璃中含有SiO2,不能用带磨口玻璃塞的试剂瓶保存碱性溶液的原因
(3)胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多
(4)在高温下一氧化碳与氧化铁反应可以制得金属铁
(5)将铁加入硫酸铜溶液中炼铜(湿法炼铜)
(6)工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙)
查看习题详情和答案>>
(1)已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电板
2FeCl3+Cu=CuCl2+2FeCl2
2FeCl3+Cu=CuCl2+2FeCl2
.(2)玻璃中含有SiO2,不能用带磨口玻璃塞的试剂瓶保存碱性溶液的原因
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(3)胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3HCl=AlCl3+3H2O
.(4)在高温下一氧化碳与氧化铁反应可以制得金属铁
3CO+Fe2O3
3CO2+2Fe
| ||
3CO+Fe2O3
3CO2+2Fe
.
| ||
(5)将铁加入硫酸铜溶液中炼铜(湿法炼铜)
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.(6)工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.42.2g K4[Fe(CN)6]?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.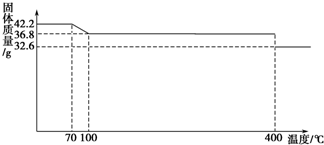
试回答下列问题:
(1)试确定150℃时固体物质的化学式 .
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为 .
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为 .
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全 .(提示:当某离子浓度小于10-5mol?L-1时可以认为该离子沉淀完全)
查看习题详情和答案>>

试回答下列问题:
(1)试确定150℃时固体物质的化学式
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全
学习化学应该明确“从生活中来,到生活中去”道理.在生产生活中,我们会遇到各种各样的化学反应.请按要求回答下列问题:
(1)铝热反应在工业生产中的重要用途之一是 ;小苏打在日常生活中的用途之一是 .
(2)写出下列反应的化学方程式.(注意反应条件并配平)
①镁带着火时,不能用液态CO2灭火剂来灭火的原因是 .
②工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉 .
(3)请你写出下列反应的离子方程式.
①胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多 .
②电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.写出该反应的离子方程式: .
查看习题详情和答案>>
(1)铝热反应在工业生产中的重要用途之一是
(2)写出下列反应的化学方程式.(注意反应条件并配平)
①镁带着火时,不能用液态CO2灭火剂来灭火的原因是
②工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉
(3)请你写出下列反应的离子方程式.
①胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多
②电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.写出该反应的离子方程式:
(2013?朝阳区二模)由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O
(1)①中产生气体的电子式是
(2)用离子方程式表示过程②中稀硝酸的作用
Ⅱ.由FeCl3?6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3?6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3)SOCl2与水接触会迅速产生白雾和SO2.加热分解FeCl3?6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因
(4)过程ⅱ中产生FeCl2的化学方程式是
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
(5)下列说法正确的是
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是
查看习题详情和答案>>
Ⅰ.按下图所示过程制备FeCl3?6H2O

(1)①中产生气体的电子式是
H:H
H:H
.(2)用离子方程式表示过程②中稀硝酸的作用
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
,在该过程中要不断向溶液中补充盐酸,目的是补充H+使NO3-继续氧化Fe2+直至NO3-完全消耗既不产生Fe(NO3)3又不引入其他杂质
补充H+使NO3-继续氧化Fe2+直至NO3-完全消耗既不产生Fe(NO3)3又不引入其他杂质
.Ⅱ.由FeCl3?6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3?6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3)SOCl2与水接触会迅速产生白雾和SO2.加热分解FeCl3?6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因
6SOCl2+FeCl3?6H2O═FeCl3+12HCl↑+6SO2↑生成的HCl会抑制FeCl3的水解得到无水FeCl3
6SOCl2+FeCl3?6H2O═FeCl3+12HCl↑+6SO2↑生成的HCl会抑制FeCl3的水解得到无水FeCl3
.(4)过程ⅱ中产生FeCl2的化学方程式是
2FeCl3+H2
2FeCl2+2HCl
| ||
2FeCl3+H2
2FeCl2+2HCl
.
| ||
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
ac
ac
.a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是
4FeCl2+H2O+O2
2FeCl3+Fe2O3+2HCl
| ||
4FeCl2+H2O+O2
2FeCl3+Fe2O3+2HCl
.
| ||
乙酰水杨酸又称阿司匹林(微溶于水),它可由水杨酸和乙酸酐反应得到.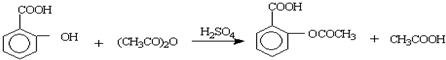
以下是阿司匹林的一种工业生产流程:
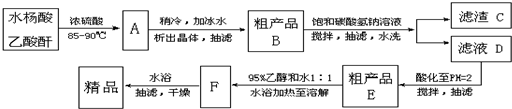
请回答以下问题:
(1)水杨酸和乙酸酐反应时最好采用
(2)粗产品应分批加入到饱和碳酸氢钠溶液中,边加边搅拌,以防止
(3)滤渣C主要成分为一种副反应产物,生成它的反应类型为
A.加聚反应 B.水解反应 C.缩聚反应 D.加成反应
(4)滤液D酸化时的离子方程式为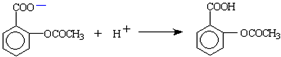
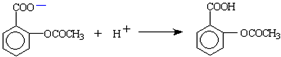 .
.
(5)请设计“检验精品是否为纯净物”的实验方案
查看习题详情和答案>>

以下是阿司匹林的一种工业生产流程:

请回答以下问题:
(1)水杨酸和乙酸酐反应时最好采用
水浴
水浴
加热,且要注意不得让水蒸汽进入反应容器,以防止乙酰水杨酸
乙酰水杨酸
和乙酸酐
乙酸酐
水解.(2)粗产品应分批加入到饱和碳酸氢钠溶液中,边加边搅拌,以防止
气泡产生过多而引起溶液外溢
气泡产生过多而引起溶液外溢
;不能
不能
(填“能”或“不能”)用氢氧化钠溶液代替饱和碳酸氢钠溶液.(3)滤渣C主要成分为一种副反应产物,生成它的反应类型为
C
C
(填选项字母).A.加聚反应 B.水解反应 C.缩聚反应 D.加成反应
(4)滤液D酸化时的离子方程式为
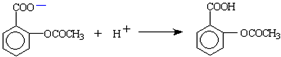
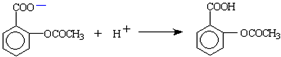
(5)请设计“检验精品是否为纯净物”的实验方案
取少量精品试样于一试管内,加1mL乙醇使之溶解,再加入几滴FeCl3溶液,若无紫色出现,则为纯净物
取少量精品试样于一试管内,加1mL乙醇使之溶解,再加入几滴FeCl3溶液,若无紫色出现,则为纯净物
.