摘要:煤是重要的化工原料.用煤作燃料不仅是极大浪费.而且固体煤中含有的硫在燃烧时生成二氧化硫气体.造成环境污染.东北某城市冬季取暖约150天.每天消耗含硫1%的煤200t.求该城市一冬向大气排放二氧化硫气体多少t?从保护环境角度考虑.请你提出一条合理化建议. 2007-2008学年度深圳宝安中学 新课标高一化学期中检测试卷 班级 姓名 学号 分数
网址:http://m.1010jiajiao.com/timu3_id_167329[举报]
煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污染。
设某具有30万户人口的中等城市,每户每天燃煤5 kg,这种煤中含FeS2 5%,燃烧时,设有90%的硫转化成二氧化硫,被排放到大气中。FeS2燃烧时化学方程式如下:
4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
问:(1)燃烧1 t煤,可产生多少千克的SO2?
(2)该中等城市如果全部以上述的煤作燃料,每年(按365天计算)将有多少吨SO2排放到大气中?
查看习题详情和答案>>煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污染。
设某具有30万户人口的中等城市,每户每天燃煤5 kg,这种煤中含FeS2 5%,燃烧时,设有90%的硫转化成二氧化硫,被排放到大气中。FeS2燃烧时化学方程式如下:
4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
问:(1)燃烧1 t煤,可产生多少千克的SO2?
(2)该中等城市如果全部以上述的煤作燃料,每年(按365天计算)将有多少吨SO2排放到大气中?
查看习题详情和答案>>煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污染。
设某具有30万户人口的中等城市,每户每天燃煤5 kg,这种煤中含FeS2 5%,燃烧时,设有90%的硫转化成二氧化硫,被排放到大气中。FeS2燃烧时化学方程式如下:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
问:(1)燃烧1 t煤,可产生多少千克的SO2?
(2)该中等城市如果全部以上述的煤作燃料,每年(按365天计算)将有多少吨SO2排放到大气中?
设某具有30万户人口的中等城市,每户每天燃煤5 kg,这种煤中含FeS2 5%,燃烧时,设有90%的硫转化成二氧化硫,被排放到大气中。FeS2燃烧时化学方程式如下:
4FeS2+11O2
 2Fe2O3+8SO2
2Fe2O3+8SO2问:(1)燃烧1 t煤,可产生多少千克的SO2?
(2)该中等城市如果全部以上述的煤作燃料,每年(按365天计算)将有多少吨SO2排放到大气中?
煤是重要的化工原料,用煤作燃料不仅是极大浪费,而且固体煤中含有的硫在燃烧时生成二氧化硫气体,造成环境污染.东北某城市冬季取暖约150天,每天消耗含硫1%的煤200 t,该城市一个冬季向大气排放多少吨二氧化硫气体?从保护环境角度考虑,请你提出一条合理化建议.
 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而
增大
增大
(增大/减小/不变).(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡
向左移
向左移
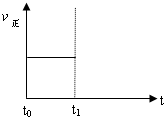
(向左移/向右移/不移动).(3)上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 0.6 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
,DMFC的总反应式为2CH3OH+3O2=2CO2+4H2O
2CH3OH+3O2=2CO2+4H2O
.