摘要:3.巩固练习 (1) 比一比.组词. 毛 和 手 知 (2) 说一说“出 的笔顺. (3)正确书写“和.知 . 第六单元复习教案 复习目的:巩固本单元生字词.能够背课文.默写生字.记住笔顺. 教学准备:生字卡片.小黑板. 复习过程:
网址:http://m.1010jiajiao.com/timu3_id_166082[举报]
烃被看作有机物的母体,请完成下列与烃的知识相关的练习:
(1) 1mol链烃最多能和2mol氯气发生加成反应,生成氯代烃。1mol该氯代烃又能和6m氯气发生取代反应,生成只含碳元素和氯元素的氯代烃。该烃的分子式
其可能的结构简式有 种
(2) 人们对苯的认识有一个不断深化的过程。
① 苯不能使溴水褪色,性质类似烷烃,但可以同液溴发生取代反应,写出反应方程式 。
 ② 烷烃中脱去2 mol氢原子形成1 mol双键要吸热,但1,3—环己二烯 (
② 烷烃中脱去2 mol氢原子形成1 mol双键要吸热,但1,3—环己二烯 (![]() )脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯 (填“稳定”或“不稳定”)。
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯 (填“稳定”或“不稳定”)。
③ 1866年凯库勒(右图)提出了苯的单、双键交替
的正六边形平面结构,解释了苯的部分性质,但
还有一些问题尚未解决,它不能解释下列
事实(填入编号)
a.苯不能使溴水褪色 b.苯能与H2发生加成反应
c.溴苯没有同分异构体 d.邻二溴苯只有一种
④ 现代化学认为苯分子碳碳之间的键是 。
查看习题详情和答案>>某学生利用如图1所示实验装置探究盐桥式原电池的工作原理.
按照实验步骤依次回答下列问题:
(1)导线中电子流向为
(2)写出装置中锌电极上的电极反应式:
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减.欲除去Cu2+,最好选用下列试剂中的
A.NaOH B.Zn C.Fe D.H2SO4
(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的
(7)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应为:2Cu+H2O
Cu2O+H2,阴极的电极反应式是
查看习题详情和答案>>

按照实验步骤依次回答下列问题:
(1)导线中电子流向为
由a到b(或a→b)
由a到b(或a→b)
(用a、b 表示).(2)写出装置中锌电极上的电极反应式:
Zn-2e-=Zn2+
Zn-2e-=Zn2+
;(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为
1.204×1022
1.204×1022
;(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是
B
B
.A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减.欲除去Cu2+,最好选用下列试剂中的
B
B
(填代号).A.NaOH B.Zn C.Fe D.H2SO4
(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的
吸氧
吸氧
腐蚀.为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的负
负
极(填“正”或“负”)相连.钢铁在呈中性的潮湿环境下的腐蚀比呈酸性时缓慢,在碱性潮湿环境下的腐蚀更缓慢,试从化学平衡角度解释碱性时比中性时更缓慢原因O2+4e-+2H2O=4OH-碱性较强时,OH-浓度较大,根据平衡移动原理,抑制了上述电极反应的发生,所以腐蚀缓慢
O2+4e-+2H2O=4OH-碱性较强时,OH-浓度较大,根据平衡移动原理,抑制了上述电极反应的发生,所以腐蚀缓慢
(写出电极反应式及必要的文字叙述).(7)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应为:2Cu+H2O
| ||
2H++2e-=H2
2H++2e-=H2
.若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为7.2
7.2
g.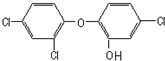 三氯生是一种抗菌剂,结构如图所示.美国弗吉尼亚理工大学教师比德的一项实验表明,含有三氯生的产品与含氯的自来水发生反应后,可形成三氯甲烷(氯仿).氯仿曾被用作麻醉剂,动物试验发现,氯仿会对心脏和肝脏造成损伤,具有轻度致畸性,可诱导小白鼠发生肝癌.下列说法正确的是( )
三氯生是一种抗菌剂,结构如图所示.美国弗吉尼亚理工大学教师比德的一项实验表明,含有三氯生的产品与含氯的自来水发生反应后,可形成三氯甲烷(氯仿).氯仿曾被用作麻醉剂,动物试验发现,氯仿会对心脏和肝脏造成损伤,具有轻度致畸性,可诱导小白鼠发生肝癌.下列说法正确的是( )| A、三氯生的分子式是C12H6Cl3O2 | B、三氯生不与浓溴水发生反应 | C、氯仿与甲烷均为正四面体结构 | D、1mol三氯生最多可与7mol NaOH反应 |
把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2 2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是( )
|
查看习题详情和答案>>