摘要:练习用“有--有--有--还有-- 说一句话. 停车场里的车真多呀!有 .有 .有 .有 .还有 . 我喜欢吃的蔬菜有 .有 .有 .还有 .
网址:http://m.1010jiajiao.com/timu3_id_166069[举报]
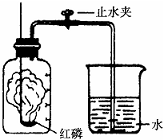 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:①将图中的集气瓶分为5等份,并作好标记.
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹
夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.
③充分反应后,待集气瓶冷却至室温,打开止水夹.
请回答下列问题:
(1)该实验中红磷需稍过量,目的是
充分反应掉集气瓶中的氧气
充分反应掉集气瓶中的氧气
.其反应的文字表达式为
红磷+氧气
五氧化二磷
| 点燃 |
红磷+氧气
五氧化二磷
;步骤③中打开止水夹后观察到的现象是| 点燃 |
水沿导管倒流进入集气瓶中,倒流至集气瓶容积的
处
| 1 |
| 5 |
水沿导管倒流进入集气瓶中,倒流至集气瓶容积的
处
,由此可得出空气中氧气的体积分数约为| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
(2)该实验可推论出氮气
难
难
(填“易”或“难”)溶于水和其化学性质不活泼
不活泼
(填“活泼”或“不活泼”)的结论.(3)若将红磷换成炭粉,该实验能否获得成功?为什么?
不能成功,木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强
不能成功,木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强
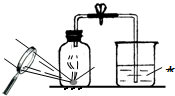
(4)某同学对实验进行反思后,提出了改进方法(如图所示 ),你认为改进后的优点是:
环保、误差小
环保、误差小
.
(4)图是测定空气中中氧气含量的实验.在实验过程中,观察到红磷燃烧的现象是:剧烈燃烧、放出大量热和
产生大量白烟
产生大量白烟
.排除了气密性不好等因素外,过量红磷燃烧熄灭后集气瓶内仍有
仍有
(填”“仍有”或“没有”)残余的氧气.(2009?湘潭一模)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.则原溶液中肯定存在的离子是
已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?
查看习题详情和答案>>
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.则原溶液中肯定存在的离子是
OH-、AlO2-、CO32-、K+
OH-、AlO2-、CO32-、K+
,肯定不存在的离子是NH4+、SO42-、SiO32-、Al3+
NH4+、SO42-、SiO32-、Al3+
.已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?
有Cl-
有Cl-
.(2013?烟台模拟)在实验室中,为验证C12>Fe3+>SO2的氧化性顺序,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已省略,气密性已经检验).

(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是
(2)关闭K1、K3、K4,打开活塞a,滴加一定量的浓盐酸,给A加热,A中发生反应的离子方程式为
(3)当B中的溶液变黄时,停止加热,夹紧弹簧夹K2并打开K5,这样做的原因是
(4)打开活塞b,使约2mL的溶液流入试管D中,滴入
(5)打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3并打开K6,用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是
(6)更新试管D,打开活塞b,使约2mL的溶液流入试管D中,检验B溶液中的离子.检验SO42-所需的试剂是
A.Ba(NO3)2溶液 B.BaC12溶液 C.AgNO3溶液 D.Ba(OH)2溶液
甲、乙、丙三位同学分别对两次B中得到的溶液进行了有关离子的检测,他们的检测结果一定能够证明氧化性C12>Fe3+>SO2的是
上装置中,棉花中浸有溶液是
查看习题详情和答案>>

(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是
排出装置中的氧气
排出装置中的氧气
.(2)关闭K1、K3、K4,打开活塞a,滴加一定量的浓盐酸,给A加热,A中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+H2O
.
| ||
(3)当B中的溶液变黄时,停止加热,夹紧弹簧夹K2并打开K5,这样做的原因是
吸收多余的氯气,防止气体压强过大而导致危险
吸收多余的氯气,防止气体压强过大而导致危险
.(4)打开活塞b,使约2mL的溶液流入试管D中,滴入
KSCN溶液
KSCN溶液
可以证明其中是否含有Fe3+离子.(5)打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3并打开K6,用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是
70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大
70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大
.(6)更新试管D,打开活塞b,使约2mL的溶液流入试管D中,检验B溶液中的离子.检验SO42-所需的试剂是
B
B
.A.Ba(NO3)2溶液 B.BaC12溶液 C.AgNO3溶液 D.Ba(OH)2溶液
甲、乙、丙三位同学分别对两次B中得到的溶液进行了有关离子的检测,他们的检测结果一定能够证明氧化性C12>Fe3+>SO2的是
乙、丙
乙、丙
.| 第一次B中溶液含有离子 | 第二次B中溶液含有离子 | |
| 甲 | 有Fe2+,无Fe3+ | 有SO 42- |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO 42- |
| 丙 | 有Fe3+,无Fe2+ | 有Fe2+ |
NaOH溶液
NaOH溶液
,其作用是吸收多余氯气、二氧化硫,防止污染空气
吸收多余氯气、二氧化硫,防止污染空气
.先选择填空,再简要说明作此选择的理由.
(1)某试管内装有约占容积
的溶液,则溶液的体积是
A、约1mL B、约3mL C、约25mL D、无法判断
(2)拟在烧杯中于加热条件下配制某溶液50mL,应选择的烧杯是
A、400mL烧杯 B、250mL烧杯 C、100mL烧杯 D、50mL烧杯.
查看习题详情和答案>>
(1)某试管内装有约占容积
| 1 | 10 |
D
D
,因为试管有多种规格,试管的容积有大有小,题目没有明确试管的规格和体积,则占其容积的1/10的溶液体积是无法确定的
试管有多种规格,试管的容积有大有小,题目没有明确试管的规格和体积,则占其容积的1/10的溶液体积是无法确定的
.A、约1mL B、约3mL C、约25mL D、无法判断
(2)拟在烧杯中于加热条件下配制某溶液50mL,应选择的烧杯是
C
C
,因为配制溶液的过程中用烧杯来溶解溶质,一般情况下选用烧杯的容积应比所配溶液的体积大一倍为宜
配制溶液的过程中用烧杯来溶解溶质,一般情况下选用烧杯的容积应比所配溶液的体积大一倍为宜
.A、400mL烧杯 B、250mL烧杯 C、100mL烧杯 D、50mL烧杯.
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔.在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸.
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫.
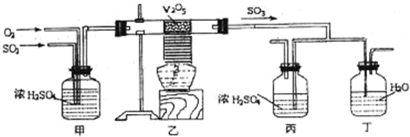
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:
(2)如图中的乙、丙分别相当于工业上制取硫酸装置中的:
(3)丙中的现象为
(4)如表是压强对SO2平衡转化率的影响
对SO2转化为SO3的反应,增大压强可使转化率
查看习题详情和答案>>
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫.

请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
;
| ||
(2)如图中的乙、丙分别相当于工业上制取硫酸装置中的:
接触室
接触室
、吸收塔
吸收塔
;(3)丙中的现象为
无酸雾
无酸雾
、丁中的现象为有酸雾
有酸雾
.(4)如表是压强对SO2平衡转化率的影响
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
增大
增大
,只所以通常采用常压操作是因为:常压下SO2的转化率已经很大
常压下SO2的转化率已经很大
.