摘要:读识字6.看图说一说图上画了什么?
网址:http://m.1010jiajiao.com/timu3_id_166065[举报]
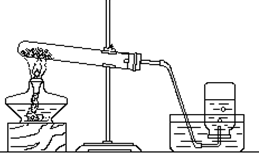 下列是某同学加热氯酸钾和二氧化锰制取氧气,装置图如图:
下列是某同学加热氯酸钾和二氧化锰制取氧气,装置图如图:(1)写出该反应的表达式:
(2)该同学用的收集方法是
(3)试管口应略
(4)实验结束时,应先把
(5)另一位同学在进行该实验时,发现试管破裂,请你帮助他分析可能的原因:(说出一种)
(6)某同学一看到气泡就开始收集,你认为这样的做法对吗?
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
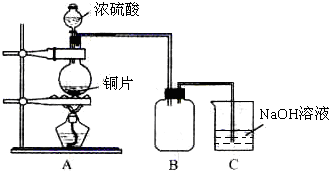
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是 ;
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度.他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是 (填写编号).
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析: [要求标明不可行的方案序号、说出不可行的理由及造成的误差(偏高或偏低)].
(4)请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算) .
查看习题详情和答案>>

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式:
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度.他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析:
(4)请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)
浓硫酸与乙二酸(H2C2O4)在加热条件下反应的化学方程式为:H2C2O4 CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
 CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。

Ⅰ.(1)D装置的作用是________。
(2)E装置的作用是________。
(3)I装置的作用是________。
Ⅱ.甲同学用上述装置,取不同质量的铁的氧化物进行实验。所得实验数据如下:
|
实验序号 |
铁的氧化物质量/g |
生成铁的质量/g |
|
1 |
4.00 |
2.81 |
|
2 |
8.00 |
7.62 |
|
3 |
10.00 |
7.01 |
|
4 |
12.00 |
8.42 |
|
5 |
14.00 |
9.81 |
|
6 |
16.00 |
12.22 |
|
7 |
18.00 |
12.63 |
|
8 |
20.00 |
14.03 |
(1)如果以y轴表示生成铁的质量,x轴表示铁的氧化物质量,请用铅笔在上面坐标图上依次找出相应的实验数据的点。

(2)从坐标图上可以看出甲进行第二次实验时,所得数据不十分可靠,故舍去。请分析造成此种结果的原因主要可能是________或________。
(3)请利用上图回答。第二次实验时生成的铁的质量约为________g(小数点后保留一位)。
(4)如果另一位同学乙取了25 g铁的氧化物样品而来不及做实验,但根据上述图示,可以求出所生成的铁的重量为________(小数点后保留一位)。将你所用方法在上图中画出。
(5)同学丙看了甲、乙两同学所做的方法后认为:只要认真进行两次实验,就以回答上述问题。请用甲同学的两组实验数据,用数学方法写出丙同学的分析过程。
(6)丁同学看了上述分析过程后,认为只要一组准确的实验数据就能解决问题。他是怎样分析的?Si+O2=SiO2
查看习题详情和答案>>
[化学--物质结构与性质]
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
(1)写出D原子的外围电子排布式
(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点
(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
在A和O之间通过双键形成AO2分子,而F和O则不能和A那样形成有限分子,原因是
(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.


则在以上分子中,中心原子采用sp3杂化形成化学键的是
(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B4(g)═2B2(g)△H=
查看习题详情和答案>>
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
3d104s1
3d104s1
,A、B、C、D四种元素的第一电离能最小的是Cu
Cu
(用元素符号表示).(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点
高
高
(填“高”或“低”).(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
C=O的键能比C-O的键能的两倍要大,Si=O的键能比Si-O的键能的两倍要小,所以Si和O成单键更稳定,而C和O以双键形成稳定分子
C=O的键能比C-O的键能的两倍要大,Si=O的键能比Si-O的键能的两倍要小,所以Si和O成单键更稳定,而C和O以双键形成稳定分子
.(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是
ce
ce
(填序号).a.离子键 b.极性键c.非极性键d.配位键 e.金属键(5)下列分子结构图中的“
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
①③
①③
(填序号);在②的分子中有3
3
个σ键和2
2
个π键.(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B4(g)═2B2(g)△H=
-(2b-6a)
-(2b-6a)
KJ/mol.A、B、C、D、E为5种短周期元素,且原子序数依次增大.A的原子半径最小;B的电子总数与其最外层电子数之比为3:2;C的最高价氧化物对应水化物与其简单氢化物反应生成一种盐类物质甲.A、E同主族,A、B、C、E都能分别与D形成原子个数比不同的常见化合物.请回答下列问题:
(1)B在周期表中位于第 族,甲的名称是 .
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为 .在微电子工业中,M的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 .
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分.现取13.0g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6.72L)和一种固体单质,则乙的化学式是 .
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.汽车内燃机工作时引起反应:C2(g)+D2(g)?2CD(g),是导致汽车尾气中含有CD的原因之一.T℃时,向容积为2L的密闭容器中充入10molC2与5molD2,达到平衡后CD的物质的量为2mol,则T℃时该反应的平衡常数K= (计算结果保留两位有效数字).在其他条件不变的情况下,再通入10molC2与5moD2,达到平衡常数时C2的转化率将 (填“增大”、“减小”或“不变”,下同),CD的平衡浓度将 .
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
△H2= .
查看习题详情和答案>>
(1)B在周期表中位于第
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分.现取13.0g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6.72L)和一种固体单质,则乙的化学式是
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.汽车内燃机工作时引起反应:C2(g)+D2(g)?2CD(g),是导致汽车尾气中含有CD的原因之一.T℃时,向容积为2L的密闭容器中充入10molC2与5molD2,达到平衡后CD的物质的量为2mol,则T℃时该反应的平衡常数K=
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
△H2=