摘要:(五)复习 4.根据儿歌.掌握方向. 5.写好上下结构的字. 6.学会正确.有礼貌地打电话.
网址:http://m.1010jiajiao.com/timu3_id_166058[举报]
(2011?东城区二模)X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在元素周期表中的位置是
(2)Z的单质与水反应的化学方程式是
(3)Y与R相比,非金属性较强的是
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是
(5)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是
查看习题详情和答案>>
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
第三周期ⅦA族
第三周期ⅦA族
;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素
同位素
.(2)Z的单质与水反应的化学方程式是
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.(3)Y与R相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列事实能证明这一结论的是bc
bc
(选填字母序号).a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是
大于0.099nm小于0.143nm
大于0.099nm小于0.143nm
.(5)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是
NaAlO2或Na2SiO3
NaAlO2或Na2SiO3
.(2010?唐山三模)请根据下图作答:
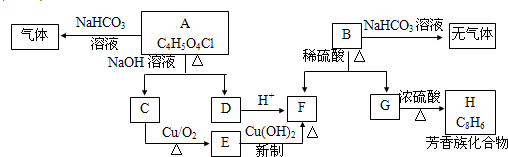
(1)E中含有的官能团的名称是
(2)B的结构简式为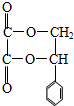
 .
.
(3)写出下列反应类型:C→E
(4)写出下列反应的化学方程式:
A→C+D
 .
.
(5)H分子中共线的原子数最多为
(6)符合下列条件的B的同分异构体(不含B)有
①它是芳香族化合物;
②分子中存在两个连续的“-CH2-”基团;
③它为二元酯类(含有两个“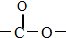 ”基团)化合物,且不发生银镜反应.写出其中一个1mol该物质最多消耗3molNaOH的同分异构体的结构简式
”基团)化合物,且不发生银镜反应.写出其中一个1mol该物质最多消耗3molNaOH的同分异构体的结构简式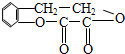
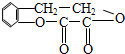 .
.
查看习题详情和答案>>

(1)E中含有的官能团的名称是
醛基
醛基
.(2)B的结构简式为


(3)写出下列反应类型:C→E
氧化反应
氧化反应
,B→F+G水解反应
水解反应
.(4)写出下列反应的化学方程式:
A→C+D
HOOC-COOCH2CH2Cl+3NaOH→NaOOC-COONa+NaCl+H2O+HOCH2CH2OH
HOOC-COOCH2CH2Cl+3NaOH→NaOOC-COONa+NaCl+H2O+HOCH2CH2OH
.G→H

(5)H分子中共线的原子数最多为
4
4
个.(6)符合下列条件的B的同分异构体(不含B)有
12
12
种.①它是芳香族化合物;
②分子中存在两个连续的“-CH2-”基团;
③它为二元酯类(含有两个“
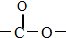 ”基团)化合物,且不发生银镜反应.写出其中一个1mol该物质最多消耗3molNaOH的同分异构体的结构简式
”基团)化合物,且不发生银镜反应.写出其中一个1mol该物质最多消耗3molNaOH的同分异构体的结构简式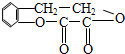
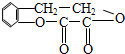
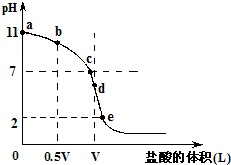 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:(1)氨水的电离方程式为
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
,该温度时氨水的电离平衡常数K=10-5
10-5
.(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为
d>c>b
d>c>b
.(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有
ACD
ACD
.A.c(H+)?c(OH-) B.
| c(H+) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3H2O) |
| c(NH3H2O)?c(H+) |
| c(NH4+) |
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)
D
D
.A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=
1
1
,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为| 11V |
| 9 |
| 11V |
| 9 |
下表数据是某科研机构在某温度下测得的金属镁、锌和镍分别在氧气中进行氧化反应时,金属表面生成氧化物薄膜的实验数据记录:
(说明:a、b、c均为与温度有关的常数)
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO: ;ZnO: .
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率: .
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是 .
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:
(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性: .
查看习题详情和答案>>
| 反应时间t (h) | 1 | 4 | 9 | 16 | 25 |
| MgO膜厚Y (nm) | 0.02a | 0.08a | 0.18a | 0.32a | 0.50a |
| ZnO 膜厚Y (nm) | 1.0×10-3b | 4.0×10-3b | 9.0×10-3b | 1.6×10-2b | 2.5×10-2b |
| NiO 膜厚Y (nm) | 0.3c | 0.6c | 0.9c | 1.2c | 1.5c |
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO:
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率:
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:

(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性:
海水是巨大的资源宝库,可以进行综合利用.从海水中提取食盐和溴的过程如下:

(1)请写出一种海水淡化的方法:
(2)步骤Ⅰ获得Br2的离子方程式为
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
查看习题详情和答案>>

(1)请写出一种海水淡化的方法:
蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法(任选一种);
蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法(任选一种);
.(2)步骤Ⅰ获得Br2的离子方程式为
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
;(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是
Br2
Br2
(填化学式).若反应中生成2molHBr,则消耗1
1
molSO2,若完全吸收后的酸溶液体积为500mL,则溶液中氢离子浓度为8
8
mol/L.(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
Cl2>Br2>SO2
Cl2>Br2>SO2
.