网址:http://m.1010jiajiao.com/timu3_id_166024[举报]

(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=
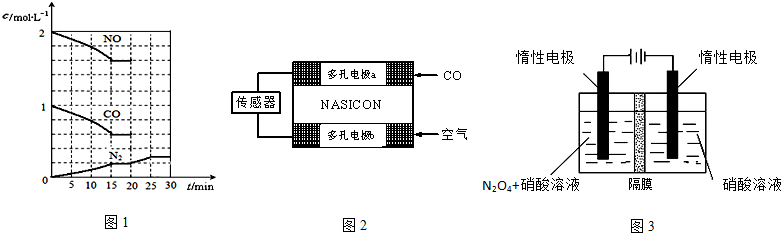
(2)汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
生成无毒物质,减少汽车尾气污染.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图1所示,则
①前15s内的平均反应速率v (N2)=
②该反应平衡常数K=
③若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
a 加入催化剂 b 降低温度 c 缩小容器体积 d 增加CO2的量
④该可逆反应△S
(3)CO分析仪以燃料电池为工作原理,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是
A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现对SO2的处理目的.其中Fe3+的最外层电子排布式为
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图3所示,N2O5在电解池的
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=______;
(2)汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
生成无毒物质,减少汽车尾气污染.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图1所示,则
①前15s内的平均反应速率v (N2)=______(小数点保留3位);
②该反应平衡常数K=______(小数点保留3位);
③若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将______移动(填“向左”、“向右”或“不”);20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是______(填序号);
a 加入催化剂 b 降低温度 c 缩小容器体积 d 增加CO2的量
④该可逆反应△S______0(填“>”、“<”或“=”),在______(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是______
A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现对SO2的处理目的.其中Fe3+的最外层电子排布式为______;SO2的VSEPR模型名称为______;与SO2互为等电子体的离子有______.
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图3所示,N2O5在电解池的______(填“阳极”或“阴极”)区生成,其电极反应式为______.

(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=______;
(2)汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
生成无毒物质,减少汽车尾气污染.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图1所示,则
①前15s内的平均反应速率v (N2)=______(小数点保留3位);
②该反应平衡常数K=______(小数点保留3位);
③若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将______移动(填“向左”、“向右”或“不”);20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是______(填序号);
a 加入催化剂 b 降低温度 c 缩小容器体积 d 增加CO2的量
④该可逆反应△S______0(填“>”、“<”或“=”),在______(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是______
A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现对SO2的处理目的.其中Fe3+的最外层电子排布式为______;SO2的VSEPR模型名称为______;与SO2互为等电子体的离子有______.
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图3所示,N2O5在电解池的______(填“阳极”或“阴极”)区生成,其电极反应式为______.
查看习题详情和答案>>
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g 铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
A.铁粉 ?????? B.钠 ???? ?? C.氯化钡溶液 ???????? D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
方案① |
|
|
|
方案② |
|
|
|
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
查看习题详情和答案>>
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | | | |
| 方案② | | | |
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。 查看习题详情和答案>>