摘要:.2Na2O2+2CO2=2Na2CO3+O2反应中,电子转移数目 A.1e- B.2e- C.3e- D.4e-
网址:http://m.1010jiajiao.com/timu3_id_166003[举报]
过氧化钠几乎可与所有的常见气态非金属氧化物反应.如:2Na2O2+2CO2═2Na2CO3+O2,Na2O2+2CO═Na2CO3.
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式: . .
(2)通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成.
查看习题详情和答案>>
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:
(2)通过比较可知,当非金属元素处于
(1)标准状况下,44.8L的NH3气体质量为
(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是
(3)过氧化钠几乎可与所有的常见气态非金属氧化物反应.如:2Na2O2+2CO2=2Na2CO3+O2; Na2O2+CO=Na2CO3试分别写出Na2O2与SO2、SO3反应的化学方程式:
(4)取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出相关的化学方程式:
①实验现象
②有关的化学方程式是
查看习题详情和答案>>
34
34
g,其中含2NA或1.204×1024
2NA或1.204×1024
个氮原子,其中含6
6
mol 氢原子.(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是
34g?mol-1
34g?mol-1
,等质量的NH3与H2R的物质的量比为2:1
2:1
,1.7g氨气与0.1
0.1
mol H2O含有的电子数相等.(3)过氧化钠几乎可与所有的常见气态非金属氧化物反应.如:2Na2O2+2CO2=2Na2CO3+O2; Na2O2+CO=Na2CO3试分别写出Na2O2与SO2、SO3反应的化学方程式:
2Na2O2+2SO3=2Na2SO4+O2、Na2O2+SO2=Na2SO4
2Na2O2+2SO3=2Na2SO4+O2、Na2O2+SO2=Na2SO4
(4)取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出相关的化学方程式:
①实验现象
钠浮在液面上,熔成一个闪亮的小球,四处游动并发出响声;溶液中生成蓝色絮状沉淀
钠浮在液面上,熔成一个闪亮的小球,四处游动并发出响声;溶液中生成蓝色絮状沉淀
②有关的化学方程式是
2Na+2H2O=2NaOH+H2↑、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
2Na+2H2O=2NaOH+H2↑、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
.写出下列反应的化学方程式
(1)Al与NaOH溶液反应:
(2)Na2O2与CO2反应:
(3)写出铁与水蒸气反应的化学方程式
(4)写出碳酸钠水解的离子方程式
(5)苯与溴反应的化学方程式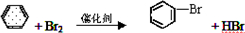
 ,反应类型
,反应类型
查看习题详情和答案>>
(1)Al与NaOH溶液反应:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
(2)Na2O2与CO2反应:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
(3)写出铁与水蒸气反应的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
| ||
(4)写出碳酸钠水解的离子方程式
CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;
CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;
(5)苯与溴反应的化学方程式


取代反应
取代反应
.D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
(1)C元素在周期表中的位置
(2)A、B元素形成的常见化合物水溶液显
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1
2BO2(g)+O2(g)?2BO3(g);△H=-196.6kJ?mol-1
则1mol BO3(g)若完全分解成B(s),反应过程中的热效应为
查看习题详情和答案>>
(1)C元素在周期表中的位置
第三周期
第三周期
周期VIIA
VIIA
族.(2)A、B元素形成的常见化合物水溶液显
碱性
碱性
性,原因是(用离子方程式表示)S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
;用石墨做电极电解该化合物的水溶液,则阴极反应式为2H++2e-=H2↑
2H++2e-=H2↑
,(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
(用元素符号表示).该反应中还原剂是Na2O2
Na2O2
.(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1
2BO2(g)+O2(g)?2BO3(g);△H=-196.6kJ?mol-1
则1mol BO3(g)若完全分解成B(s),反应过程中的热效应为
吸收395.1kJ热量(或+395.1kJ)
吸收395.1kJ热量(或+395.1kJ)
.