摘要:22.NaOH溶液中主要有Na+.OH-和H2O.在该溶液中滴入酚酞试液呈红色.你通过何种途径证明引起酚酞变色的微粒.
网址:http://m.1010jiajiao.com/timu3_id_164613[举报]
工业上对海水资源综合开发利用的部分工艺流程如图1所示.
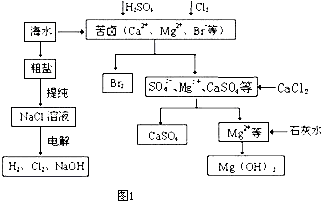
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na2CO3溶液后相关化学反应的离子方程式:
(2)本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
(3)氯化钠是重要的氯碱工业化工的原料.电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是
A.Cl- B.Na+ C.OH- D.Cl2
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为
(5)氯化钠的可用于生产纯碱,我国化学家侯德榜改革国外生产工艺,生产流程简要表示如图2:
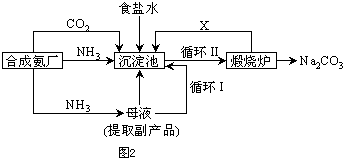
①上述生产纯碱的方法称
写出上述流程中X物质的分子式
②合成氨原料气中氮气制备的方法之一为
③沉淀池中发生的化学反应方程式是
④为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
查看习题详情和答案>>

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na2CO3溶液后相关化学反应的离子方程式:
Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
.(2)本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
否
否
(填“能”或“否”),原因是如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
.(3)氯化钠是重要的氯碱工业化工的原料.电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是
B
B
.A.Cl- B.Na+ C.OH- D.Cl2
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为
氧化反应,2Cl--2e-=Cl2↑
氧化反应,2Cl--2e-=Cl2↑
,与电源负极线连的电极附近溶液pH变大
变大
(变大、不变、变小).(5)氯化钠的可用于生产纯碱,我国化学家侯德榜改革国外生产工艺,生产流程简要表示如图2:

①上述生产纯碱的方法称
联合制碱法
联合制碱法
,副产品的一种用途为做化肥
做化肥
.写出上述流程中X物质的分子式
CO2
CO2
.使原料氯化钠的利用率从70%提高到90%以上,主要是设计了Ⅰ
Ⅰ
(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是过滤
过滤
.②合成氨原料气中氮气制备的方法之一为
液态空气依据沸点分离
液态空气依据沸点分离
,另一原料气氢气的制取化学方程式为C+H2O
CO+H2,CO+H2O
CO2+H2
| ||
| ||
C+H2O
CO+H2,CO+H2O
CO2+H2
.
| ||
| ||
③沉淀池中发生的化学反应方程式是
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
.要实现该反应,你认为应该如何操作:向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体
向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体
;④为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
用硝酸酸化的硝酸银,观察产生白色沉淀
用硝酸酸化的硝酸银,观察产生白色沉淀
.(2011?浦东新区一模)(1)Solvay制碱(氨碱)法和侯德榜(联合)制碱法的基本原理均可用反应方程式表示为:
NaCl+
将NaHCO3沉淀滤出后,母液中残留的离子主要有Cl-、NH4+和
a.强酸性 b.强碱性 c.接近中性
Solvay对母液的基本处理是:加入
如果从海水中提取的食盐未经精制(提纯),所得纯碱中含有的难溶性杂质将主要是
(2)工业上需要对溶液进行碱化时,常用氨水替代NaOH.好处何在,请说出你对此的看法.
a.
查看习题详情和答案>>
NaCl+
H2O+NH3+CO2
H2O+NH3+CO2
→NaHCO3↓+NH4Cl
NH4Cl
将NaHCO3沉淀滤出后,母液中残留的离子主要有Cl-、NH4+和
Na+
Na+
、HCO3-
HCO3-
.该母液的酸碱性为c
c
(选择填充).a.强酸性 b.强碱性 c.接近中性
Solvay对母液的基本处理是:加入
石灰
石灰
.Solvay法中氨气、二氧化碳
氨气、二氧化碳
是循环使用的.侯德榜对母液的基本处理是:加入氨气
氨气
和食盐
食盐
,得到重要的副产品氯化铵
氯化铵
.侯德榜法中食盐和二氧化碳
食盐和二氧化碳
是部分循环使用的.如果从海水中提取的食盐未经精制(提纯),所得纯碱中含有的难溶性杂质将主要是
Mg(OH)2
Mg(OH)2
和CaCO3
CaCO3
(用化学式表示).(2)工业上需要对溶液进行碱化时,常用氨水替代NaOH.好处何在,请说出你对此的看法.
a.
成本较低;
成本较低;
. b.可同时制得氮肥
可同时制得氮肥
.化学工业在国民经济中占有极其重要的地位,江苏省是国内最早的硫酸生产基地之一。主要方程式和主要设备: (黄铁矿的主要成分为FeS2) 4FeS2+11O2 = 2Fe2O3+8SO2 (沸腾炉) 2SO2+O2![]() 2SO3 (接触室) SO3+H2O=H2SO4(吸收塔)
2SO3 (接触室) SO3+H2O=H2SO4(吸收塔)
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.接触室的反应使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触室中的氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)0.1mol/L的NaHSO3溶液中,有关粒子浓度由大到小的顺序为:
c (Na+)>c (HSO3-)>c (SO32-)>c (H2SO3)
①该溶液中c (H+) c (OH-)(填“>”、“=” 或“<” ),其理由是(用离子方程式表示): 。
②现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是 ,反应的离子方程式为: 。
查看习题详情和答案>>(2013?莱芜一模)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时
V正
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01
mol?L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
查看习题详情和答案>>
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5
5
C+4
4
KMnO4+6
6
H2SO4→5
5
CO2↑+4
4
MnSO4+2
2
K2SO4+6
6
H2O(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
0.17
0.17
.②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值
小于1
小于1
(填具体值或取值范围).③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时
V正
<
<
V逆(填“<”,“>”,“=”).(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol
CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01
mol?L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
;(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
1.12×10-4
1.12×10-4
mol/L.(一)、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5为 , (填“酸性”、“中性”或“碱性”)
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)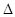 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g) 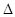 H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(二)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式______
(2)下列各项中,能说明元素C比E非金属性强的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
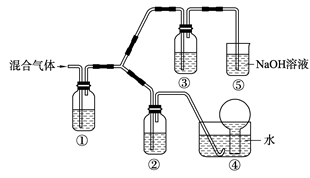
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2=NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应装置②、③中盛放的药品依次是______、______。
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4x10ˉ6 | 6x 10ˉ6 | 2x10ˉ5 | 4x10ˉ5 | 3x10ˉ5 | 2x10ˉ5 |
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)
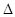 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g) 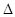 H= -110.5KJ/mol
H= -110.5KJ/mol写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(二)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式______
(2)下列各项中,能说明元素C比E非金属性强的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。

已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2=NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应装置②、③中盛放的药品依次是______、______。
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。