摘要:19. (1)CH4+100H--8e-=CO32-+7H2O 2O2+4H2O+8e-=8OH- 增大
网址:http://m.1010jiajiao.com/timu3_id_164504[举报]
下列用来表示物质变化的化学用语中,正确的是( )
A.次氯酸钙溶液中通入过量的SO2:ClO-+H2O+SO2=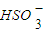 +HClO
+HClO
B.钢铁发生电化学腐蚀的正极反应:4OH--4e-═2H2O+O2↑
C.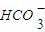 的水解:
的水解: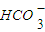 +H2O?
+H2O?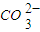 +H3O+
+H3O+
D.甲烷碱性燃料电池的负极反应:CH4+100H--8e-═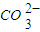 +7H2O
+7H2O
查看习题详情和答案>>
A.次氯酸钙溶液中通入过量的SO2:ClO-+H2O+SO2=
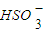 +HClO
+HClOB.钢铁发生电化学腐蚀的正极反应:4OH--4e-═2H2O+O2↑
C.
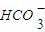 的水解:
的水解: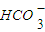 +H2O?
+H2O?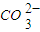 +H3O+
+H3O+D.甲烷碱性燃料电池的负极反应:CH4+100H--8e-═
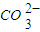 +7H2O
+7H2O查看习题详情和答案>>
下列用来表示物质变化的化学用语中,正确的是
- A.次氯酸钙溶液中通入过量的SO2:ClO-+H2O+SO2=
 +HClO
+HClO - B.钢铁发生电化学腐蚀的正极反应:4OH--4e-═2H2O+O2↑
- C.
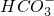 的水解:
的水解: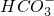 +H2O?
+H2O?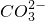 +H3O+
+H3O+ - D.甲烷碱性燃料电池的负极反应:CH4+100H--8e-═
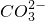 +7H2O
+7H2O
(1)将质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为
(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2
所占的体积由大到小的顺序是(填序号,下同)
所含原子数由多到少的顺序是
密度由大到小的顺序是
(3)标准状况下将224LHCl气体完全溶于1L水中,所得溶液的密度为1.1g/cm3,则所得稀盐酸的质量分数为
查看习题详情和答案>>
1:1
1:1
,氮原子和氧原子的个数比为3:1
3:1
,该混合气体的平均摩尔质量为29g/mol
29g/mol
.(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2
所占的体积由大到小的顺序是(填序号,下同)
②④③①⑤
②④③①⑤
;所含原子数由多到少的顺序是
②④①③⑤
②④①③⑤
;密度由大到小的顺序是
⑤①③④②
⑤①③④②
.(3)标准状况下将224LHCl气体完全溶于1L水中,所得溶液的密度为1.1g/cm3,则所得稀盐酸的质量分数为
26.74%
26.74%
,物质的量浓度为8.3mol/L
8.3mol/L
.已知25℃、101kpa时,一些物质的燃烧热为:
请回答下列问题.
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)=CH3OH(l);△H=
(3)现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是:
A.1:1 B.1:3 C.1:4 D.2:3.
查看习题详情和答案>>
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△=-726.5KL/mol
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△=-726.5KL/mol
.(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)=CH3OH(l);△H=
-128.1KJ/mol
-128.1KJ/mol
.(3)现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是:
D
D
A.1:1 B.1:3 C.1:4 D.2:3.