网址:http://m.1010jiajiao.com/timu3_id_164304[举报]
过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。

请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。

①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
查看习题详情和答案>>
过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。
请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
查看习题详情和答案>>
过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。
请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
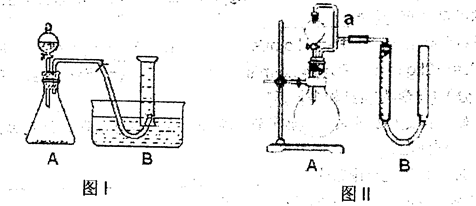
请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
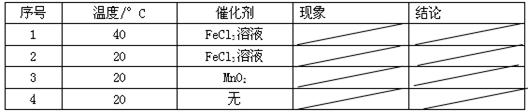
①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
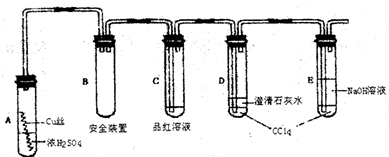
以下是该学习小组部分交流记录及后续探究实验的记录.
材料一:小组交流记录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4.
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S
| ||
材料二、探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化.
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸、黑色明显变浅,溶液呈蓝绿色.
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减小10%左右.
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是;
的作用是
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失.写出淡黄色固体消失的化学反应方程式:
| ||
| ||
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀.学生1猜想是由于SO2溶解度较大,生成了Ca(SHO3)2的缘故.请你设计实验验证学生1的猜想
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是:
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对比,学生2提出猜想是:铜与浓硫酸反应生成的硫酸铜水解使溶液呈酸性,请写出该水解反应的离子方程式:
 Cu(OH)2+2H+
Cu(OH)2+2H+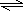 Cu(OH)2+2H+
Cu(OH)2+2H+你的猜想是:
请你设计一个简单的实验以验证你的猜想:
(6)该研究性学习小组的同学为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至80℃-100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末X.冷却后称量,X的质量为72g.向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,据此可推得,X的化学式为