摘要:14.根据下列反应判断还原剂的还原性由强到弱的顺序正确的是 ( ) ①C+ H2O══CO + H2 ②C+ CO2══2CO ③CO+ H2O══CO2 + H2 A.C>H2>CO B.C>CO>H2 C.H2>C>CO D.CO>H2>C
网址:http://m.1010jiajiao.com/timu3_id_164085[举报]
根据表中信息判断,下列选项不正确的是( )

A.第①组反应中,H2O2作还原剂
B.第②组反应中,Cl2与FeBr2的物质的量之比为3:2
C.第③组反应中,每生成1mo1C12转移电子2mol
D.从三个反应可以得出:氧化性由强到弱顺序为![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
(1)写出Fe2(SO4)3在水溶液中的电离方程式:______
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑______
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
该反应中氧化剂与还原剂物质的量之比为______
该反应的离子方程式为______
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是______.
查看习题详情和答案>>
(1)写出Fe2(SO4)3在水溶液中的电离方程式:______
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑______
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
MnCl2+Cl2↑+2H2O
该反应中氧化剂与还原剂物质的量之比为______
该反应的离子方程式为______
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是______.
查看习题详情和答案>>
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑______
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
| ||
该反应中氧化剂与还原剂物质的量之比为______
该反应的离子方程式为______
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是______.
(1)写出Fe2(SO4)3在水溶液中的电离方程式:
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
该反应中氧化剂与还原剂物质的量之比为
该反应的离子方程式为
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是 . 查看习题详情和答案>>
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O该反应中氧化剂与还原剂物质的量之比为
该反应的离子方程式为
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是 . 查看习题详情和答案>>
苯酚具有弱酸性,在空气中易被氧化.工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为:
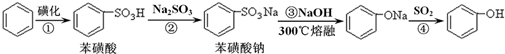
(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为 (填序号).
A.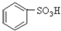 B.
B.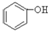 C.H2SO3
C.H2SO3
(2)步骤④与使用CO2相比,使用SO2的优点是 (答一个方面).
(3)经反应④得到的产物除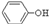 外、可能还含有OH-、S
外、可能还含有OH-、S
、HS
等微粒.请设计实验方案,证明溶液中存在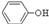 、S
、S
、HS
,写出实验步骤、预期现象和结论.
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol?L-1盐酸、1mol?L-1 BaCl2溶液、品红溶液、0.01mol?L-1酸性KMnO4溶液、1mol?L-1FeCl3溶液、饱和溴水等.
(4)纯度测定:称取1.00g产品溶解于足量温水中,向其中加入足量饱和溴水(产品中除苯酚外,不含其它与饱和溴水反应生成沉淀的物质),苯酚全部生成三溴苯酚沉淀,经过滤、洗涤、干燥后,称得沉淀质量为3.31g,则产品中苯酚的质量分数为 .
查看习题详情和答案>>

(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为
A.
 B.
B. C.H2SO3
C.H2SO3(2)步骤④与使用CO2相比,使用SO2的优点是
(3)经反应④得到的产物除
 外、可能还含有OH-、S
外、可能还含有OH-、S| O | 2- 3 |
| O | - 3 |
 、S
、S| O | 2- 3 |
| O | - 3 |
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol?L-1盐酸、1mol?L-1 BaCl2溶液、品红溶液、0.01mol?L-1酸性KMnO4溶液、1mol?L-1FeCl3溶液、饱和溴水等.
| 实验步骤 | 预期现象和结论 | ||
| 步骤1:取少量待测液于试管中,加入足量的1mol?L-1BaCl2溶液,静置、过滤,得滤液和沉淀.将滤液分置于试管A、B中,沉淀置于试管C中. | |||
| 步骤2:往试管A中加入 |
| ||
| 步骤3:往试管B中加入 |
|||
| 步骤4:往试管C中加入2mol?L-1盐酸酸化,再滴入1~2滴品红溶液. |
|