题目内容
(1)写出Fe2(SO4)3在水溶液中的电离方程式:(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O该反应中氧化剂与还原剂物质的量之比为
该反应的离子方程式为
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是 .
【答案】分析:(1)Fe2(SO4)3在水溶液中完全电离;
(2)2H++CO32-=H2O+CO2↑对应的化学反应为酸与碳酸氢盐的反应;
(3)MnO2+4HCl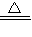 MnCl2+Cl2↑+2H2O,反应中MnO2为氧化剂,HCl为还原剂,
MnCl2+Cl2↑+2H2O,反应中MnO2为氧化剂,HCl为还原剂,
反应的离子方程式为:MnO2+4H++2Cl-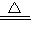 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)根据氧化还原反应中氧化剂的氧化性对应还原剂的氧化性判断.
解答:解:(1)Fe2(SO4)3在水溶液中的电离方程式为:Fe2(SO4)3=2Fe2++3SO42-,故答案为:Fe2(SO4)3=2Fe2++3SO42-;
(2)2H++CO32-=H2O+CO2↑对应的化学反应为酸与碳酸氢盐的反应,化学方程式可写为HCl+NaHCO3-=H2O+NaCl+CO2↑,故答案为:HCl+NaHCO3-=H2O+NaCl+CO2↑;
(3)MnO2+4HCl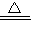 MnCl2+Cl2↑+2H2O,反应中Mn:+4降为+2,得到2mol电子,MnO2是氧化剂,还原产物是Mn2+
MnCl2+Cl2↑+2H2O,反应中Mn:+4降为+2,得到2mol电子,MnO2是氧化剂,还原产物是Mn2+
Cl:-1升为0,失去1 mol电子,由于有2mol Cl化合价改变,所以共失去2mol电子,HCl是还原剂,氧化产物是Cl2,氧化剂和还原剂的物质的量之比为1:2,反应的离子方程式为MnO2+4H++2Cl-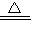 Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
电子转移的方向和数目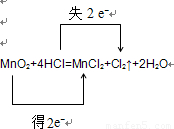
故答案为: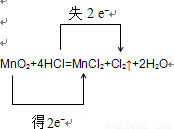 ;1:2;MnO2+4H++2Cl-
;1:2;MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)①反应中Cl2>I2;
②反应中Cl2>FeCl3;
③反应中FeCl3>I2;
④反应中I2>S,所以氧化性顺序为Cl2>FeCl3>I2>S,故答案为:Cl2>FeCl3>I2>S.
点评:本题考查较为综合,涉及电离方程式、离子方程式、氧化还原反应等问题,题目难度中等,注意氧化性的强弱比较方法.
(2)2H++CO32-=H2O+CO2↑对应的化学反应为酸与碳酸氢盐的反应;
(3)MnO2+4HCl
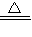 MnCl2+Cl2↑+2H2O,反应中MnO2为氧化剂,HCl为还原剂,
MnCl2+Cl2↑+2H2O,反应中MnO2为氧化剂,HCl为还原剂,反应的离子方程式为:MnO2+4H++2Cl-
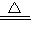 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;(4)根据氧化还原反应中氧化剂的氧化性对应还原剂的氧化性判断.
解答:解:(1)Fe2(SO4)3在水溶液中的电离方程式为:Fe2(SO4)3=2Fe2++3SO42-,故答案为:Fe2(SO4)3=2Fe2++3SO42-;
(2)2H++CO32-=H2O+CO2↑对应的化学反应为酸与碳酸氢盐的反应,化学方程式可写为HCl+NaHCO3-=H2O+NaCl+CO2↑,故答案为:HCl+NaHCO3-=H2O+NaCl+CO2↑;
(3)MnO2+4HCl
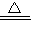 MnCl2+Cl2↑+2H2O,反应中Mn:+4降为+2,得到2mol电子,MnO2是氧化剂,还原产物是Mn2+
MnCl2+Cl2↑+2H2O,反应中Mn:+4降为+2,得到2mol电子,MnO2是氧化剂,还原产物是Mn2+Cl:-1升为0,失去1 mol电子,由于有2mol Cl化合价改变,所以共失去2mol电子,HCl是还原剂,氧化产物是Cl2,氧化剂和还原剂的物质的量之比为1:2,反应的离子方程式为MnO2+4H++2Cl-
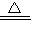 Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,电子转移的方向和数目

故答案为:
 ;1:2;MnO2+4H++2Cl-
;1:2;MnO2+4H++2Cl-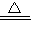 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;(4)①反应中Cl2>I2;
②反应中Cl2>FeCl3;
③反应中FeCl3>I2;
④反应中I2>S,所以氧化性顺序为Cl2>FeCl3>I2>S,故答案为:Cl2>FeCl3>I2>S.
点评:本题考查较为综合,涉及电离方程式、离子方程式、氧化还原反应等问题,题目难度中等,注意氧化性的强弱比较方法.

练习册系列答案
相关题目

 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O