摘要:075mol 0.075mol 0.075mol Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 1mol 3mol 1mol y 3y y Fe + Fe2(SO4)3=3FeSO4 1mol 1mol 3mol y y 3y x=y+0.0075mol 苏教版必修1专题3 第一单元课时练习2 铝的氢氧化物(B卷)
网址:http://m.1010jiajiao.com/timu3_id_163643[举报]
(2012?信阳二模)将4mol A和2mol B放入2L密闭容器中发生反应2A(g)+B(g)?2C(g),△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
查看习题详情和答案>>
Ⅰ、表中①~⑥为部分短周期元素的化合价及原子半径
Ⅱ、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
Ⅲ、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙.
A、B、C均为上表中的元素,甲、乙为中学常见强酸.
请回答下列问题(1)写出B元素位于周期表中的位置
(2)A元素气态氢化物的结构式为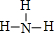
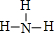 ,写出上述元素形成的最稳定的氢化物的电子式
,写出上述元素形成的最稳定的氢化物的电子式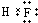
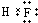 _
_
(3)下列关于物质甲、乙的说法中正确的是
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应
d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式
写出工业生产强酸乙的过程中制备化合物AB的化学方程式
查看习题详情和答案>>
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
Ⅲ、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙.
A、B、C均为上表中的元素,甲、乙为中学常见强酸.
请回答下列问题(1)写出B元素位于周期表中的位置
第二周期第ⅥA族
第二周期第ⅥA族
(2)A元素气态氢化物的结构式为
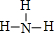
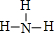
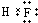
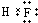
(3)下列关于物质甲、乙的说法中正确的是
ab
ab
(填字母)a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应
d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
写出工业生产强酸乙的过程中制备化合物AB的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| 高温高压 |
4NH3+5O2
4NO+6H2O
.
| ||
| 高温高压 |
几种短周期元素的原子半径及其主要化合价如下表所示.下列叙述正确的是( )
|
查看习题详情和答案>>
下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族) .
(2)8个元素的最高价氧化物的水化物中,酸性最强的是 (填化学式).
(3)①元素和⑥元素形成化合物的电子式是 .
(4)写出④最高价氧化物对应水化物与①最高价氧化物对应水化物反应的离子方程式: .
(5)比较半径大小Na+ O2-(填>,=,<=)
(6)下列叙述正确的是 (填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
查看习题详情和答案>>
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是(周期、族)
(2)8个元素的最高价氧化物的水化物中,酸性最强的是
(3)①元素和⑥元素形成化合物的电子式是
(4)写出④最高价氧化物对应水化物与①最高价氧化物对应水化物反应的离子方程式:
(5)比较半径大小Na+
(6)下列叙述正确的是
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
下表是短周期中部分元素的原子半径及主要化合价.
请回答:
(1)X在元素周期表中的位置是 ;
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小的顺序(用离子符号表示)是 ;并用离子方程式表示出Z离子可作净水剂的原因 ;
(3)M的单质能跟V的最高价氧化物水化物的热浓溶液发生氧化还原反应,生成两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式 ;
(4)W、X、Y分别与U均可形成10电子共价化合物,晶体类型均为 ,其中,属于非极性分子的是(写化学式) ,若将其作为燃料,以熔融的K2CO3为电解质,空气作为氧化剂,并选择适当的惰性电极,组成原电池.写出该电池工作时的负极反应式 .
查看习题详情和答案>>
| 元素代号 | U | V | W | X | Y | Z | M |
| 原子半径/nm | 0.037 | 0.157 | 0.074 | 0.075 | 0.077 | 0.143 | 0.102 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 | -2,+6 |
(1)X在元素周期表中的位置是
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小的顺序(用离子符号表示)是
(3)M的单质能跟V的最高价氧化物水化物的热浓溶液发生氧化还原反应,生成两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式
(4)W、X、Y分别与U均可形成10电子共价化合物,晶体类型均为