摘要: Mg 2 Al(OH)3 (3)Al 33.6
网址:http://m.1010jiajiao.com/timu3_id_163590[举报]
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
请回答下列问题:
(1)操作①的名称
过滤
过滤
(2)检验溶液Ⅱ中是否含有Fe3+的方程式 (最优方法)
Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
(3)沉淀A与萤石(CaF2)在硫酸酸化下可以制备石膏,写出反应方程式
2CaF2+2H2SO4+SiO2═2CaSO4+SiF4↑+2H2O
2CaF2+2H2SO4+SiO2═2CaSO4+SiF4↑+2H2O
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为
OH-+Al(OH)3═AlO2-+2H2O
OH-+Al(OH)3═AlO2-+2H2O
(5)操作②中应控制溶液pH的合理范围是
C
C
(填序号).A.小于1.5B.1.5~3.3 C.7~8 D.大于9.4
(6)为探究所得的水合碱式碳酸镁[xMgCO3?yMg(OH)2?zH2O]的组成,取样18.2g g于装置A的玻璃管中,请按由左-→右顺序将下列装置连接好(如图乙)(填序号,装置可重复使用):
C-→B-→A-→B-→D-→B(或D)
C-→B-→A-→B-→D-→B(或D)
,装置C应盛的试剂是NaOH溶液
NaOH溶液
. 充分反应后,如果实验测得硬质玻璃管中剩余固体8.0g,共放出6.6gCO2气体,则x:y:z=3:1:3
3:1:3
.蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如图所示.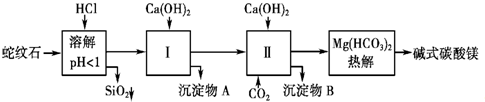
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是
(5)现设计一个实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③
④
⑤MgO称量
(6)18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a=
查看习题详情和答案>>

(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
Fe3+、Al3+
Fe3+、Al3+
.| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
Al(OH)3
Al(OH)3
溶解、Mg(OH)2
Mg(OH)2
沉淀.(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入
NaOH或Ca(OH)2
NaOH或Ca(OH)2
(填入物质的化学式),然后过滤、洗涤、灼烧
过滤、洗涤、灼烧
(依次填写实验操作名称).(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是
CaCO3或CO2
CaCO3或CO2
(填写物质化学式).(5)现设计一个实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③
用浓硫酸吸收水蒸气
用浓硫酸吸收水蒸气
.④
称量碱石灰吸收CO2前后的质量
称量碱石灰吸收CO2前后的质量
.⑤MgO称量
(6)18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a=
3
3
,b=1
1
,c=3
3
.