摘要:有两种短周期元素X.Y.它们的原子序数分别为8和11.下列有关X.Y两种元素的描述中正确的是 A.X元素只能形成-2价的化合物 B.Y位于元素周期表的第3周期第IIA族 C.X原子的半径大于Y原子的半径 D.X.Y之间能形成Y2X和Y2X2两种离子化合物
网址:http://m.1010jiajiao.com/timu3_id_163359[举报]
短周期元素X、Y、Z、W、Q的原子序数依次增大.Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料.请回答:
(1)Y在元素周期表中的位置是
(2)W2Z的电子式是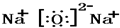
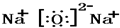 .
.
(3)W2Z2与X2Z反应的化学方程式是
(4)上述元素中有两种非金属元素位于同一主族,能证明它们非金属性强弱的一个反应的化学方程式是
(5)在25℃、101kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0kJ,则该反应的热化学方程式是
查看习题详情和答案>>
(1)Y在元素周期表中的位置是
第二周期第ⅣA族
第二周期第ⅣA族
.(2)W2Z的电子式是
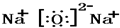
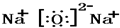
(3)W2Z2与X2Z反应的化学方程式是
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.(4)上述元素中有两种非金属元素位于同一主族,能证明它们非金属性强弱的一个反应的化学方程式是
CO2+H2O+Na2SiO3=Na2CO3+H2SiO3(胶体)
CO2+H2O+Na2SiO3=Na2CO3+H2SiO3(胶体)
.(5)在25℃、101kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0kJ,则该反应的热化学方程式是
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
.
短周期元素X、Y、Z、W、Q的原子序数依次增大.Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料.请回答:
(1)Y在元素周期表中的位置是______.
(2)W2Z的电子式是______.
(3)W2Z2与X2Z反应的化学方程式是______.
(4)上述元素中有两种非金属元素位于同一主族,能证明它们非金属性强弱的一个反应的化学方程式是______.
(5)在25℃、101kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0kJ,则该反应的热化学方程式是______.
查看习题详情和答案>>
(1)Y在元素周期表中的位置是______.
(2)W2Z的电子式是______.
(3)W2Z2与X2Z反应的化学方程式是______.
(4)上述元素中有两种非金属元素位于同一主族,能证明它们非金属性强弱的一个反应的化学方程式是______.
(5)在25℃、101kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0kJ,则该反应的热化学方程式是______.
查看习题详情和答案>>
短周期元素X、Y、Z、W、Q的原子序数依次增大,Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料.请回答:
(1)Y在元素周期表中的位置是________.
(2)X2Z的电子式是________.
(3)W2Z2与X2Z反应的化学方程式是________.
(4)上述元素中有两种非金属元素位于同一主族.能证明它们非金属性强弱的一个反应的化学方程式是________.
(5)在25℃、101 kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1 mol e-放热190.0 kJ.则该反应的热化学方程式是________.