网址:http://m.1010jiajiao.com/timu3_id_162805[举报]
[化学——化学与生活]
下列内容都与人们的生活和健康密切相关,请根据要求填空:
(1)学生要注意合理膳食,注意食品的多样化,防止某种营养成分过多或过少。请回答下列问题:
①大米的主要成分在人体内最终变成了 (填名称)而被人体吸收。
②坏血病是由于缺乏维生素C而引起的,下列有关维生素C的说法正确的是 。
A.维生素C是脂溶性维生素,易在体内积存
B.维生素C可作食品添加剂
C.维生素C虽然被称为抗坏血酸,但![]() 它的水溶液并不呈酸性
它的水溶液并不呈酸性
![]() D.维生素C在水溶液中或受热时很容易被氧化,所以生吃新鲜蔬菜要比熟吃时维生素C的损失少
D.维生素C在水溶液中或受热时很容易被氧化,所以生吃新鲜蔬菜要比熟吃时维生素C的损失少
③蔬菜、水果中维生素C的含量较高,缺乏维生素C的同学在膳食中应该增加蔬菜、水果的摄入量,许多蔬菜、水果(如柠檬酸等)是 (填“酸性食物”或“碱性食物”)。
(2)下表是我国部分城市空气质量周报,阅读并回答下列问题:
| 城市 | 污染 指数 | 首要 污染物 | 空气质量级别 | 城市 | 污染 指数 | 首要[来源:Zxxk.Com] 污染物 | 空气质量级别 |
| 北京 | 92 | TSP | II | 济南 | 76 | TSP | II |
| 天津 | 82 | TSP | II | 武汉 | 83 | NOx | II |
| 哈尔滨 | 96 | TSP | II | 重庆 | 98 | SOx | II |
| 上海 | 74 | NOx | II | 长沙 | 61 | TSP | II |
| 注:TSP——空气中的飘尘 | |||||||
①最容易出现酸雨的城市是______;为减少城市酸雨的产生,可采取以下措施中的 。
A.禁止用煤作燃料
B.改善燃煤质量,限制高硫煤炭的开采
C.向已酸化的土壤中加石灰
D.调整和优化能源结构,加快开发和利用新能源。
②汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式____________________________________________________________。
(3)水是生命之源,动植物的生命活动与其密切相关,回答下列问题:?
①工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是 。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加氢氧化钠中和 | 中和法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 沉淀法 |
| C | 含苯废水 | 用活性炭吸附 | 物理法 |
| D | 悬浮物 | 加明矾 | 混凝法 |
![]() ②我省湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种污染物的最高允许排放浓度如下表:
②我省湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种污染物的最高允许排放浓度如下表:
| 污染物 | 汞 | 镉 | 铅 |
| 主要存在形式 | Hg2+ | Cd2+ | Pb2+ |
| 最高允许排放浓度/(mg·dm-3) | 0.05 | 0.1 | 1.0 |
现有某工厂每日排放的污水中汞的质量分数为(1×10-6)%,镉的质量分数为(2×10-5)%,铅的质量分数为(5×10-5)%(设该污水的密度为1 g/cm3)。根据计算该厂三项污染物中 超标。
查看习题详情和答案>>(1)m=____________,M(Bn)= ____________。
(2)下列关于Bn性质的描述,错误的是( )
A.具有不稳定性
B.常温、常压下,密度比空气大
C.具有强氧化性
D.常温、常压下为一种具有特殊气味的无色气体
(3)若Am为正四面体型分子,1 mol Am分子中含有的共价键为____________mol,A元素最高价氧化物对应的水化物与KOH等物质的量反应的离子方程式为_____________________。
查看习题详情和答案>>A、
B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;C、D、E三种元素原子的最外层电子数之和为10,C原子电子数比E原子电子数少5个.B的单质分子中有三对共用电子.请回答下列问题:
(1)A、C两元素形成的原子个数比为1∶1,且呈电中性的微粒的电子式为________、________.
(2)A、
C、D可形成化合物W,其含有的化学键有________,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式为________以铁棒为电极,W溶液为电解液构成电解池,则阴极的电极反应为________.(3)A2
和B2在工业上可合成一种重要的原料BA3.①
下列的措施有利于提高B2的转化率的是________A.
釆用20~50 MPa的大气压B.
选用400~500℃的高温C.
使用催化剂D.
及时将BA3液化②现有甲、乙两个同定体积的容器,在相同的体积和温度下,甲中充入
2 mol BA3,反应达到平衡时,吸收Q1 kJ的能量;乙中充入1 mol B2和3 mol A2,反应达到平衡时,放出Q2 kJ的能量;合成BA3的热化学方程式为________(4)用
D2C2在酸性条件下处理含CN-的工业废水,将得到N2及CO2等物质,请写出该反应的离子方程式________.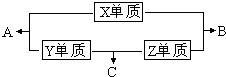 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而M的单质在常温常压下为固体,并且M元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置
(2)化合物C在一定条件下生成化合物A的化学方程式
| ||
| △ |
| ||
| △ |
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,得到pH=5的溶液,反应后的溶液存在的平衡体系有
(4)实验室里为制取C,常在C的浓溶液中加入生石灰.请叙述产生C的原因
(5)已知Y单质和Z单质生成C的反应是可逆反应,△H<0.将等物质的量的单质Y和单质Z充入一密闭容器中,在适当催化剂和恒温条件下反应.下列说法中正确的是
a.达到化学平衡时,正反应与逆反应速率相等
b.反应过程中,单质Y的体积分数始终为50%
c.达到化学平衡时,Y单质和Z单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡时,再升高温度,C的体积分数增大
(6)由X、Z、M三种元素可以形成化合物M2Z6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则发生的有关化学方程式为
| 加热 |
| 加热 |
(1)A单质、B单质、化合物R的熔点高低顺序为
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R>B单质
(2)CB3分子的空间构型是
(3)写出D原子的核外电子排布式
(4)B元素和D元素的电负性大小关系为
(5)A与B形成的离子化合物的晶胞中,每个A+周围与它距离相等且最近的B-有