网址:http://m.1010jiajiao.com/timu3_id_162751[举报]
| |||||||||||||||||||||||||||||
(14分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解反应存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,即“强酸制弱酸。”如:
2CH3COOH + Na2CO3 = 2CH3COONa +CO2↑+H2O
若换个角度分析,它同样揭示出类似的一个规律:一种较强碱与另一种较弱碱的盐可以自发地反应,生成较弱碱和较强碱的盐,即“强碱制弱碱。”依照此规律,请判断下列反应不能成立的是: (填编号)。
A、HCN + CH3COONa = NaCN + CH3COOH
B、CO2+H2O +NaClO=NaHCO3+HClO
C、CO2 +H2O +C6H5ONa![]() NaHCO3+C6H5OH
NaHCO3+C6H5OH
D、CO2 +H2O +2C6H5ONa![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E、Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F、CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是 ____ (填编号);其pH为____ (填数值);pH最大的是___ (填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。已知下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液;
②侯氏制碱法中,向氨化的饱和食盐水中通入足量二氧化碳气体可析出小苏打晶体;
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体.
请你根据上述反应,总结出复分解反应发生的另一条规律:
。
现在,将KⅠ溶液和AgCl固体混合搅拌,会观察到的现象是:
请写出反应的离子方程式: 。
查看习题详情和答案>>(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g)=2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H =-534.0 kJ·mol-1
NO2(g)
 1/2N2O4(g) △H =-26.35 kJ·mol-1
1/2N2O4(g) △H =-26.35 kJ·mol-1试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)联氨——空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。该电池放电时,正极的电极反应式为 。
(3)在300℃时,改变起始反应物中氢气的物质的量对反应N2(g) + 3H2(g)
 2NH3(g) △H<0的影响如图所示。
2NH3(g) △H<0的影响如图所示。
①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 (填字母)。
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2
若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
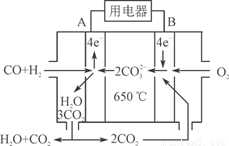
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
查看习题详情和答案>>
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。