网址:http://m.1010jiajiao.com/timu3_id_162626[举报]
A、B、C、D为四种原子序数依次增大的短周期元素,其中A、C和B、D分别是同一主族元素,并且A、C两元素质子数之和为B、D两元素质子数之和的一半。请回答下列问题:
(l)写出由上述元素形成的具有漂白作用的四种物质的化学式____________、________________、________________、________________。
(2)写出由B、C 两元素形成且含非极性共价键的化合物的电子式_______________。
(3)由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用离子方程式表示呈碱性的原因:______________________________________________________。
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应生成气体的化学方程式:_______________________________________________。
(5)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_____________________ 。
(6)D的单质能跟C的最高价氧化物水化物的浓溶液共热发生反应,生成两种正盐,写出反应的化学方程式________________________________________________。
查看习题详情和答案>>
(1)根据表中数据判断CCl4的稳定性____(填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范 围____<C-Br键能<____。
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g) △H=-QkJ/mol;通过计算确定热化学方程式中Q的值为________。由热化学方程式2H2(g)+S2(s)=2H2S(g) △H=-224. 5kJ/mol,以及表中数值可计算出1mol
S2(s)气化时将____(填“吸收”或“放出”)____kJ热量。
(3)共价键的极性强弱对化学反应有很大的影响。卤代烃RX在同样条件下发生碱性水解反应时,RF、
RCl、RBr、RI(R相同)的反应活性由大到小的顺序是____________。
(4)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释:________________。
(5)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大)______(填“能”或“不能”)。
②非金属性越强的原子形成的共价键越牢固____(填“能”或“不能”)。能否从数据找出一些规律,请写出一条:________________。
A.由同种元素组成的物质一定是纯净物
B.由两种元素组成的分子中一定不存在非极性共价键
C.含有离子键的化合物一定是离子化合物
D.非金属原子之间不可能形成离子化合物
查看习题详情和答案>>
| |||||||||||||||||||||||||||||||||
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体.下列关于分子晶体和原子晶体的说法正确的是
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示.下列说法正确的是
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为
(4)邻硝基苯酚的熔点
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素.下列有关的四种化合
物中,键角最小的是
A、CO2 B、CF4 C、NF3 D、OF2
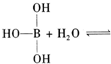
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因.
请写出下面这个方程式右端的两种离子的表达式:
 查看习题详情和答案>>
查看习题详情和答案>>