网址:http://m.1010jiajiao.com/timu3_id_162437[举报]
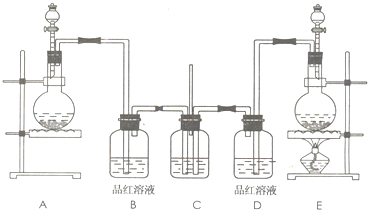
请回答下列问题:
(1)实验室制取氯气的化学方程式为
| ||
| ||
(2)实验室常用浓硫酸与亚硫酸钠固体反应制取二氧化硫,则其反应装置为上图中的
(3)装置C中试剂的名称及作用是
(4)反应开始后,发现B、D两个装置中的品红溶液都褪色.请设计一个简单实验,证明二氧化硫和氯气漂白品红溶液的原理不同,实验方法、预期的现象和结论为
(5)若将B、D装置中的品红溶液换为滴有酚酞的氢氧化钠溶液,反应一段时间后,B、D中的现象是
(6)实验结束后,经检验,发现装置C中的溶液呈碱性,并且含有SO42-.试写出C中生成的离子方程式(有多种可能,只写出一个即可)
(7分)
有一瓶澄清的溶液,其中可能含有NH4+ 、 K+ 、 Na+ 、 Mg2+、 Ba2+ 、 Al3+ 、
Fe3+、Cl-、Ⅰ-、 NO3-、CO32 -、SO42- 中的几种, 取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色;
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生;
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成;。
(5)根据以上实验事实确定①该溶液肯定存在的离子是 ;②肯定不存在的离子是_____________________________;③还不能确定的离子是________________________,要确定其中的阳离子可利用的方法原理是________________
查看习题详情和答案>>
(7分)
有一瓶澄清的溶液,其中可能含有NH4+ 、 K+ 、 Na+ 、 Mg2+、 Ba2+、 Al3+ 、
Fe3+、Cl-、Ⅰ-、 NO3-、CO32 -、SO42- 中的几种, 取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色;
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生;
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成;。
(5)根据以上实验事实确定①该溶液肯定存在的离子是 ;②肯定不存在的离子是_____________________________;③还不能确定的离子是________________________,要确定其中的阳离子可利用的方法原理是________________
查看习题详情和答案>>
(7分)
有一瓶澄清的溶液,其中可能含有NH4+、 K+、 Na+ 、 Mg2+、 Ba2+、 Al3+、
Fe3+、Cl-、Ⅰ-、 NO3-、CO32 -、SO42-中的几种,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色;
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生;
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成;。
(5)根据以上实验事实确定①该溶液肯定存在的离子是 ;②肯定不存在的离子是_____________________________;③还不能确定的离子是________________________,要确定其中的阳离子可利用的方法原理是________________
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是________________。
(2)Ⅱ中,需加一定量酸,该酸最好是_____________。运用化学平衡原理简述该酸的作用__________________________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是___________________________________ 若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_______________________________________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是_________________________________________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2==2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)