网址:http://m.1010jiajiao.com/timu3_id_162136[举报]
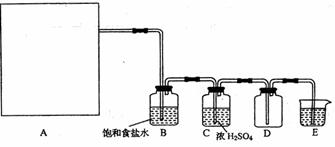
(12分)实验室用下图所示的实验装置制取纯净干燥的无水CuCl2。
|
 回答下列问题:
回答下列问题:(1) 仪器按上图连接好后,在添加药品前必须进行的实验操作是 。
(2) 装置A中发生的化学反应方程式是
 。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。
。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。(3) 装置B的广口瓶中盛有 (写名称),其作用是 ;装置C中盛有 (写名称),其作用是 。
(4) 写出D中发生的化学反应方程式 ,E的作用是 。 查看习题详情和答案>>
(12分)实验室用下图所示的实验装置制取纯净干燥的无水CuCl2。
|
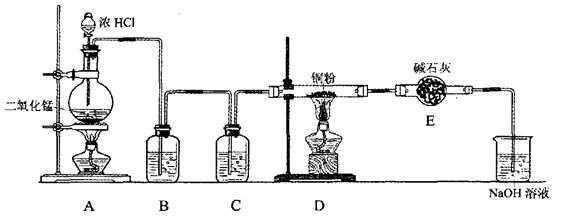
回答下列问题:
(1) 仪器按上图连接好后,在添加药品前必须进行的实验操作是 。
(2) 装置A中发生的化学反应方程式是 。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。
(3) 装置B的广口瓶中盛有 (写名称),其作用是 ;装置C中盛有 (写名称),其作用是 。
(4) 写出D中发生的化学反应方程式 ,E的作用是 。
查看习题详情和答案>>
(12分)实验室用下图所示的实验装置制取纯净干燥的无水CuCl2。
|
回答下列问题:
(1) 仪器按上图连接好后,在添加药品前必须进行的实验操作是 。
(2) 装置A中发生的化学反应方程式是 。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。
(3) 装置B的广口瓶中盛有 (写名称),其作用是 ;装置C中盛有 (写名称),其作用是 。
(4) 写出D中发生的化学反应方程式 ,E的作用是 。
查看习题详情和答案>>
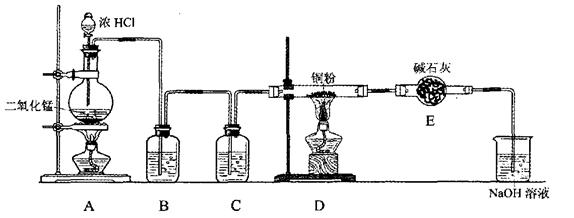
I. 实验室里用二氧化锰和浓盐酸加热制取氯气,该反应的离子方程式为: MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O,也可以利用反应:
Mn2++Cl2↑+2H2O,也可以利用反应:
2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,部分装置如图所示:
|
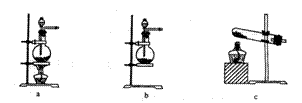
(1)若以KMnO4和浓盐酸为原料制取氯气,请根据反应原理从下图中选择合适的制气装置 (填代号)。
|
(2)装置B的作用是 。
(3)E中的试剂可选用 (填代号)。
A.NaOH溶液 B.Na2CO3溶液 C.NaCl溶液 D.水
(4)某学生通过下列两种方式制取氯气:
①用8.7gMnO2与足量浓盐酸反应制取Cl2
②用含14.6gHCl的浓盐酸与足量MnO2反应制取Cl2
这两种方式产生Cl2的量的关系是 。
A.①多 B.②多 C.①②一样多
II.现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
(1)写出发生反应的离子方程式 ;
|
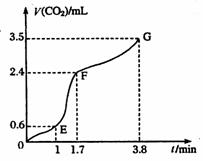
[V(CO2)]与时间(t)的关系如图
所示,试分析判断OE段、EF段、
FG段反应速率[分别用![]() (OE)、
(OE)、![]()
(EF)、![]() (FG)表示]的大小关系
(FG)表示]的大小关系
;比较OE段和EF
段,说明EF段速率变化的主要原因
应该是 。
查看习题详情和答案>>