摘要:(1)因汽油易挥发 (2)二者反应生成难电离的水 (3)因碳和O2的总能量大于CO2的能量 (4)酒精是非电解质在水中不能电离出自由移动的离子.
网址:http://m.1010jiajiao.com/timu3_id_161942[举报]
(2008?平顶山模拟)、某学习生小组为探究乙酸、碳酸和硅酸的酸性强弱并证明乙酸为弱酸,进行下述实验.
Ⅰ.探究乙酸、碳酸和硅酸的酸性强弱关系,该小组设计了如实验装置(夹持仪器已略去).
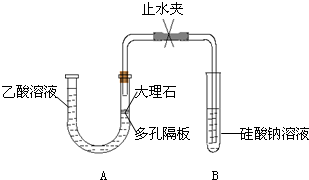
(1)实验前如何检查装置A的气密性?
(2)装置A中反应产生的气体通入试管B溶液中,有白色胶状沉淀生成,说明碳酸酸性比硅酸强.
有学生认为B中的实验现象不足以证明碳酸的酸性比硅酸强,理由是:
a、乙酸易挥发,乙酸气体随CO2气体进入试管B的溶液中,和硅酸钠溶液反应生成沉淀.
b、该复分解反应生成的硅酸是难溶固体,不能说明是因为生成弱酸而发生反应.
为了证明碳酸能和硅酸钠反应生成硅酸沉淀,下列方法中可行是
①在仪器A、B之间连接盛有足量饱和NaHCO3溶液的洗气瓶
②在仪器A、B之间连接装有足量碱石灰的干燥管
③在仪器A、B之间连接盛有足量饱和Na2CO3溶液的洗气瓶
④用碳酸钠粉末代替大理石进行实验
下列能够说明碳酸比硅酸酸性强的事实是
①相同温度时,碳酸的溶解度比硅酸的溶解度大
②碳酸比硅酸易分解
③相同温度下,相同物质的量浓度的Na2CO3和Na2SiO3溶液,Na2CO3溶液的pH比Na2SiO3溶液的pH小
④常温下,CO2是气体,SiO2是固体
Ⅱ.证明乙酸为弱酸.
现有常温下pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:
查看习题详情和答案>>
Ⅰ.探究乙酸、碳酸和硅酸的酸性强弱关系,该小组设计了如实验装置(夹持仪器已略去).

(1)实验前如何检查装置A的气密性?
仪器连接好后,将止水夹夹紧,在A中加入水使U型管左右两边管中产生液面差,一段时间后,U型管中左右两边管中的液面未发生变化
仪器连接好后,将止水夹夹紧,在A中加入水使U型管左右两边管中产生液面差,一段时间后,U型管中左右两边管中的液面未发生变化
;(2)装置A中反应产生的气体通入试管B溶液中,有白色胶状沉淀生成,说明碳酸酸性比硅酸强.
有学生认为B中的实验现象不足以证明碳酸的酸性比硅酸强,理由是:
a、乙酸易挥发,乙酸气体随CO2气体进入试管B的溶液中,和硅酸钠溶液反应生成沉淀.
b、该复分解反应生成的硅酸是难溶固体,不能说明是因为生成弱酸而发生反应.
为了证明碳酸能和硅酸钠反应生成硅酸沉淀,下列方法中可行是
①
①
(填序号).①在仪器A、B之间连接盛有足量饱和NaHCO3溶液的洗气瓶
②在仪器A、B之间连接装有足量碱石灰的干燥管
③在仪器A、B之间连接盛有足量饱和Na2CO3溶液的洗气瓶
④用碳酸钠粉末代替大理石进行实验
下列能够说明碳酸比硅酸酸性强的事实是
③
③
(填序号).①相同温度时,碳酸的溶解度比硅酸的溶解度大
②碳酸比硅酸易分解
③相同温度下,相同物质的量浓度的Na2CO3和Na2SiO3溶液,Na2CO3溶液的pH比Na2SiO3溶液的pH小
④常温下,CO2是气体,SiO2是固体
Ⅱ.证明乙酸为弱酸.
现有常温下pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:
取pH=3的乙酸溶液加入蒸馏水稀释100倍
取pH=3的乙酸溶液加入蒸馏水稀释100倍
用pH试纸测定溶液的pH小于5
用pH试纸测定溶液的pH小于5
.海洋是资源的宝库,海水中所含食盐高达4×1016t.用海水可生产食盐和金属镁或镁的化合物,其过程如下图所示.

请回答:
(1)贝壳主要成分的化学式
(2)步骤④反应的离子方程式
(3)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤.
A.粗盐提纯过程中过滤的目的是
①获得NaCl晶体 ②除去难溶性物质 ③除去易挥发物质 ④除去可溶性物质
B.过滤需要用到的玻璃仪器有玻璃棒
(4)Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物.某些材料因含有Mg(OH)2而具有阻燃性.简析Mg(OH)2能够阻燃的原因.
①
(5)电解MgCl2制金属Mg的反应方程式为:MgCl2
Mg+Cl2↑.电解0.2molMgCl2可生成金属Mg
查看习题详情和答案>>

请回答:
(1)贝壳主要成分的化学式
CaCO3
CaCO3
.(2)步骤④反应的离子方程式
Mg(OH)2+2H+=Mg2++2H2O
Mg(OH)2+2H+=Mg2++2H2O
.(3)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤.
A.粗盐提纯过程中过滤的目的是
②
②
(填序号)①获得NaCl晶体 ②除去难溶性物质 ③除去易挥发物质 ④除去可溶性物质
B.过滤需要用到的玻璃仪器有玻璃棒
漏斗
漏斗
、烧杯
烧杯
.(4)Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物.某些材料因含有Mg(OH)2而具有阻燃性.简析Mg(OH)2能够阻燃的原因.
①
Mg(OH)2受热分解生成MgO难熔物覆盖在可燃物表面阻止了可燃物的燃烧
Mg(OH)2受热分解生成MgO难熔物覆盖在可燃物表面阻止了可燃物的燃烧
; ②分解生成的水会降低环境的温度
分解生成的水会降低环境的温度
.(5)电解MgCl2制金属Mg的反应方程式为:MgCl2
| ||
4.8
4.8
g,同时可得到氯气4.48
4.48
L(标准状况).化学-选修物质结构与性质:A、B、C、D、E、F均为常见的短周期元素,原子序数依次增大,已知:①A元素中的一种原子没有中子.
②B元素原子最外层电子数是次外层电子数的2倍.
③C元素最高正价与最低负价的代数和为2.
④A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤E2+离子的电子层结构与氖原子相同.
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物.
⑦C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为
 ,化合物AFD的电子式为
,化合物AFD的电子式为
 ,B2A2的结构式为
,B2A2的结构式为
(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式
(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为
查看习题详情和答案>>
②B元素原子最外层电子数是次外层电子数的2倍.
③C元素最高正价与最低负价的代数和为2.
④A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤E2+离子的电子层结构与氖原子相同.
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物.
⑦C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为
11H
11H
,F简单阴离子的结构示意图



H-C≡C-H
H-C≡C-H
.(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式
NCl3
NCl3
;分子中C、F原子间的化学键的类型为极性键
极性键
(填“极性键”或“非极性键”),属于极性
极性
分子(填“极性”或“非极性”),X与水反应的化学方程式为NCl3+3H2O=NH3+3HClO
NCl3+3H2O=NH3+3HClO
.(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为
C3N4
C3N4
,Y的硬度比金刚石硬度大的原因是二者均为原子晶体,N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的硬度比金刚石硬度大
二者均为原子晶体,N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的硬度比金刚石硬度大
.钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等].某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:

(1)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(2)酸溶过程中,除发生了BaSO3+2HNO3=Ba(NO3)2+SO2↑+H2O外,BaSO3与HNO3还发生另一个反应,其离子方程式为
(3)结合本厂实际,选用的X为
(4)沉淀转化在生产和科研中具有极其生要的应用.在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液.写出BaSO4转化为BaCO3的离子方程式
查看习题详情和答案>>

(1)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
防止反应速率过快
防止反应速率过快
、浓HNO3易挥发、分解
浓HNO3易挥发、分解
.(2)酸溶过程中,除发生了BaSO3+2HNO3=Ba(NO3)2+SO2↑+H2O外,BaSO3与HNO3还发生另一个反应,其离子方程式为
3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O
3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O
.(3)结合本厂实际,选用的X为
BaCO3
BaCO3
(填化学式);最后的废渣中除含少量的BaSiO3、H2SiO3(H4SiO4)及原有的难溶性杂质外还含有Fe(OH)3、BaSO4
Fe(OH)3、BaSO4
(填化学式).(4)沉淀转化在生产和科研中具有极其生要的应用.在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液.写出BaSO4转化为BaCO3的离子方程式
BaSO4+CO32-=BaCO3+SO42-
BaSO4+CO32-=BaCO3+SO42-
.(2013?江苏三模)乙酰基二茂铁是常用的汽油的抗震剂,由二茂铁合成乙酰基二茂铁的原理如下:
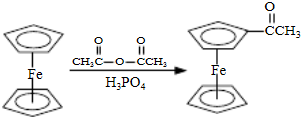
其实验步骤如下:
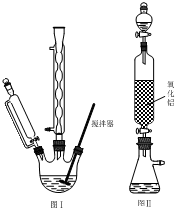 步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.
步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.
步骤2:待反应液冷却后,倒入烧杯中加入10g碎冰,搅拌至冰全部融化,缓慢滴加NaHCO3溶液中和至中性,置于冰水浴中15min.抽滤,烘干,得到乙酰基二茂铁粗产品.
步骤3:将乙酰基二茂铁粗产品溶解在苯中,从图Ⅱ装置的分液漏斗中滴下,再用乙醚淋洗.
步骤4:将其中一段时间的淋洗液收集,并进行操作X,得到纯净的针状晶体乙酰基二茂铁并回收乙醚.
(1)步骤2中的抽滤操作,除烧杯、玻璃棒外,还必须使用属于硅酸盐材质的仪器有
(2)步骤2中不需要测定溶液的pH就可以判断溶液接近中性,其现象是
(3)步骤3将粗产品中杂质分离实验的原理是
(4)步骤4中操作X的名称是
(5)为确定产品乙酰基二茂铁中是否含有杂质二乙酰基二茂铁(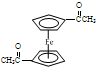 ),可以使用的仪器分析方法是
),可以使用的仪器分析方法是
查看习题详情和答案>>

其实验步骤如下:
 步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.
步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.步骤2:待反应液冷却后,倒入烧杯中加入10g碎冰,搅拌至冰全部融化,缓慢滴加NaHCO3溶液中和至中性,置于冰水浴中15min.抽滤,烘干,得到乙酰基二茂铁粗产品.
步骤3:将乙酰基二茂铁粗产品溶解在苯中,从图Ⅱ装置的分液漏斗中滴下,再用乙醚淋洗.
步骤4:将其中一段时间的淋洗液收集,并进行操作X,得到纯净的针状晶体乙酰基二茂铁并回收乙醚.
(1)步骤2中的抽滤操作,除烧杯、玻璃棒外,还必须使用属于硅酸盐材质的仪器有
布氏漏斗、抽滤瓶
布氏漏斗、抽滤瓶
.(2)步骤2中不需要测定溶液的pH就可以判断溶液接近中性,其现象是
滴加NaHCO3溶液不再产生气泡
滴加NaHCO3溶液不再产生气泡
.(3)步骤3将粗产品中杂质分离实验的原理是
不同物质在扩散剂中扩散的速率不同
不同物质在扩散剂中扩散的速率不同
.(4)步骤4中操作X的名称是
蒸馏
蒸馏
,该操作中不能使用明火的原因是乙醚易挥发且易燃
乙醚易挥发且易燃
.(5)为确定产品乙酰基二茂铁中是否含有杂质二乙酰基二茂铁(
 ),可以使用的仪器分析方法是
),可以使用的仪器分析方法是质谱法或核磁共振氢谱
质谱法或核磁共振氢谱
.