摘要:10].写出下列离子方程式相应的化学方程式 (1)Al+3Ag+=Al3++3Ag (2)CO32-+CO2+H2O=2HCO3-
网址:http://m.1010jiajiao.com/timu3_id_161889[举报]
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。
查看习题详情和答案>>
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下: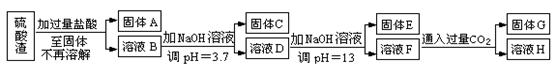
查资料得知:
| 物质名称 | 溶度积(Ksp) | pH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。 查看习题详情和答案>>
A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子),其中
①A+、B2-、F3+核外电子层结构相同
②C-是由两种元素组成的
③D是两种元素组成的四原子分子
④E在常温下是无色液体
⑤往含 F3+的溶液中滴加含C-的溶液,先有白色沉淀生成,继续滴加后,白色沉淀消失请回答:
(1)写出下列粒子的元素符号:A
(2)E的电子式
 .
.
(3)D的晶体类型为
(4)写出 F3+和含过量C-的溶液反应的离子方程式:
查看习题详情和答案>>
①A+、B2-、F3+核外电子层结构相同
②C-是由两种元素组成的
③D是两种元素组成的四原子分子
④E在常温下是无色液体
⑤往含 F3+的溶液中滴加含C-的溶液,先有白色沉淀生成,继续滴加后,白色沉淀消失请回答:
(1)写出下列粒子的元素符号:A
Na
Na
BMg
Mg
FAl
Al
.(2)E的电子式


(3)D的晶体类型为
分子
分子
,将D通入E中所得的溶液显碱性,用化学方程式和离子方程式解释其原因:NH3+H2O NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-
 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-NH3+H2O NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-
. NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-(4)写出 F3+和含过量C-的溶液反应的离子方程式:
Al3++4OH-═[Al(OH)4]-
Al3++4OH-═[Al(OH)4]-
.(2007?淄博三模)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
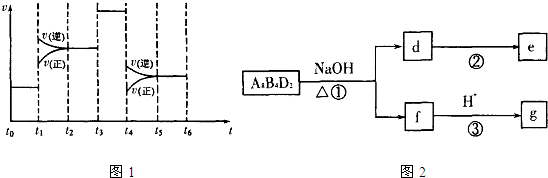
(4)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图1表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
(5)化合物A8B4D2有如图2转化关系.其中,g是常用调味品的主要成分.写出反应①的化学方程式
设计实验方案完成d→e的转化
查看习题详情和答案>>
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
10-4:1
10-4:1
.(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
Ba2++HCO3-+OH-═BaCO3↓+H2O
Ba2++HCO3-+OH-═BaCO3↓+H2O
.(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
Al+4OH-═AlO2-+2H2O+3e-
Al+4OH-═AlO2-+2H2O+3e-
.(4)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图1表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
t0~t1
t0~t1
.温度为T℃时,将4a mol A2和2a mol C2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数| 4 |
| a2 |
| 4 |
| a2 |
(5)化合物A8B4D2有如图2转化关系.其中,g是常用调味品的主要成分.写出反应①的化学方程式
CH3COOC2H5+NaOH
CH3COONa+CH3CH2OH
| △ |
CH3COOC2H5+NaOH
CH3COONa+CH3CH2OH
| △ |
设计实验方案完成d→e的转化
取一根光洁铜丝绕成螺旋状,放在酒精灯外焰加热,然后伸入d中,反复几次,观察到铜丝由红→黑→红,并闻到液体有刺激性气味
取一根光洁铜丝绕成螺旋状,放在酒精灯外焰加热,然后伸入d中,反复几次,观察到铜丝由红→黑→红,并闻到液体有刺激性气味

(2009?浙江)单晶硅是信息产业中重要的基础材料.通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式
(2)装置A中g管的作用是
装置E中的h瓶需要冷却的理由是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
查看习题详情和答案>>

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)装置A中g管的作用是
平衡压强,使液体顺利流出并防止漏气
平衡压强,使液体顺利流出并防止漏气
;装置C中的试剂是浓硫酸
浓硫酸
;装置E中的h瓶需要冷却的理由是
产物SiCl4沸点低,需要冷凝收集
产物SiCl4沸点低,需要冷凝收集
.(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
Al、P、Cl
Al、P、Cl
(填写元素符号).(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
否
否
(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点
KMnO4溶液的紫红色可指示反应终点
.②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
4.480%
4.480%
.