摘要:8.判断是否为离子反应.依据是否有处于 或 状态下的 参加反应.复分解反应.实质是 之间的反应.发生反应的条件是有 . 或 物质中的一种生成.
网址:http://m.1010jiajiao.com/timu3_id_161504[举报]
(2013?闵行区一模)根据反应:2Na2CO3+SnO2+4S
Na2SO4+Na2SnS3+2CO2↑.
回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为
(2)在上述反应中单质物质的原子核外共有
(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,测得Na2SnS3溶液pH>7,请用离子方程式表示其原因:
查看习题详情和答案>>
| 高温 |
回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为
2s22p4
2s22p4
.在上述反应的生成物中,属于分子晶体的结构式O=C=O
O=C=O
.(2)在上述反应中单质物质的原子核外共有
16
16
种不同运动状态的电子,有5
5
种不同能量的电子.(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是
bd
bd
(选填编号).a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,测得Na2SnS3溶液pH>7,请用离子方程式表示其原因:
SnS32-+H2O?HSnS3-+OH-
SnS32-+H2O?HSnS3-+OH-
. (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116KJ?mol-1
又知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则甲醇的燃烧热为
-739kJ?mol-1
-739kJ?mol-1
.(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2,5min后达平衡时CH3OH物质的量为2mol.该反应的速率v(H2)为
0.4mol/(L?min)
0.4mol/(L?min)
;下列措施中有利于增大该反应的反应速率且提高转化率的是d
d
.a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
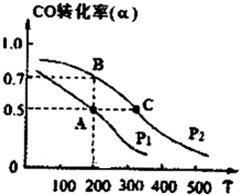
(3)在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示.
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA
大于
大于
tc(填“大于”、“小于’’或“等于“).②若A点时容器的体积为10L,该温度下B点的平衡常数K=
1
1
.(4)Na2SO3的水溶液呈
碱
碱
(填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示):SO32-+H2O?HSO3-+OH-
SO32-+H2O?HSO3-+OH-
;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
(已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9).
某学习小组设计了如图装置进行浓、稀硝酸分别与NO反应的实验,以探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去).
还可选用的药品:浓硝酸、3mol?L-1稀硝酸、蒸馏水、浓硫酸、足量氢氧化钠溶液
已知:
①浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此可得出浓硝酸的氧化性强于稀硝酸的结论.
②氢氧化钠溶液不与NO反应,但能与NO2发生反应,生成NaNO3与NaNO2
(1)加药品时,若已知③中装的是稀硝酸,为了达到探究目的,并避免实验过程有害气体排放到空气中,则还应在装置②、④、⑥中依次加入的药品是
(2)滴加浓硝酸之前,应打开弹簧夹a,通入N2一段时间,目的是
(3)写出装置①中发生反应的化学方程式
(4)装置②的作用是
(5)该小组得出探究结论所依据的实验现象是
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下4个实验来判断两种看法是否正确.这些方案中可行的是(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化.
查看习题详情和答案>>

还可选用的药品:浓硝酸、3mol?L-1稀硝酸、蒸馏水、浓硫酸、足量氢氧化钠溶液
已知:
①浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此可得出浓硝酸的氧化性强于稀硝酸的结论.
②氢氧化钠溶液不与NO反应,但能与NO2发生反应,生成NaNO3与NaNO2
(1)加药品时,若已知③中装的是稀硝酸,为了达到探究目的,并避免实验过程有害气体排放到空气中,则还应在装置②、④、⑥中依次加入的药品是
水
水
、浓硝酸
浓硝酸
、氢氧化钠溶液
氢氧化钠溶液
.(2)滴加浓硝酸之前,应打开弹簧夹a,通入N2一段时间,目的是
赶净装置中的空气,使整个装置充满氮气,防止装置②中反应生成的NO被空气氧化
赶净装置中的空气,使整个装置充满氮气,防止装置②中反应生成的NO被空气氧化
.关闭弹簧夹a后,还应进行的操作是将装置⑤中的导管末端伸入倒置的烧瓶内
将装置⑤中的导管末端伸入倒置的烧瓶内
,然后再打开弹簧夹b,滴加浓硝酸.(3)写出装置①中发生反应的化学方程式
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.(4)装置②的作用是
将NO2转化为NO
将NO2转化为NO
.装置⑥的作用是2NO2+2OH-=NO3-+NO2-+H2O
2NO2+2OH-=NO3-+NO2-+H2O
(用离子方程式表示).(5)该小组得出探究结论所依据的实验现象是
装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
.(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下4个实验来判断两种看法是否正确.这些方案中可行的是(选填序号字母)
acd
acd
.a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化.
某学习小组设计了如图装置进行浓、稀硝酸分别与NO反应的实验,以探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去).
还可选用的药品:浓硝酸、3mol?L-1稀硝酸、蒸馏水、浓硫酸、足量氢氧化钠溶液
已知:
①浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此可得出浓硝酸的氧化性强于稀硝酸的结论.
②氢氧化钠溶液不与NO反应,但能与NO2发生反应,生成NaNO3与NaNO2
(1)加药品时,若已知③中装的是稀硝酸,为了达到探究目的,并避免实验过程有害气体排放到空气中,则还应在装置②、④、⑥中依次加入的药品是______、______、______.
(2)滴加浓硝酸之前,应打开弹簧夹a,通入N2一段时间,目的是______.关闭弹簧夹a后,还应进行的操作是______,然后再打开弹簧夹b,滴加浓硝酸.
(3)写出装置①中发生反应的化学方程式______.
(4)装置②的作用是______.装置⑥的作用是______(用离子方程式表示).
(5)该小组得出探究结论所依据的实验现象是______.
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下4个实验来判断两种看法是否正确.这些方案中可行的是(选填序号字母)______.
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化.
查看习题详情和答案>>
某学习小组设计了如图装置进行浓、稀硝酸分别与NO反应的实验,以探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去).

还可选用的药品:浓硝酸、3mol?L-1稀硝酸、蒸馏水、浓硫酸、足量氢氧化钠溶液
已知:
①浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此可得出浓硝酸的氧化性强于稀硝酸的结论.
②氢氧化钠溶液不与NO反应,但能与NO2发生反应,生成NaNO3与NaNO2
(1)加药品时,若已知③中装的是稀硝酸,为了达到探究目的,并避免实验过程有害气体排放到空气中,则还应在装置②、④、⑥中依次加入的药品是______、______、______.
(2)滴加浓硝酸之前,应打开弹簧夹a,通入N2一段时间,目的是______.关闭弹簧夹a后,还应进行的操作是______,然后再打开弹簧夹b,滴加浓硝酸.
(3)写出装置①中发生反应的化学方程式______.
(4)装置②的作用是______.装置⑥的作用是______(用离子方程式表示).
(5)该小组得出探究结论所依据的实验现象是______.
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下4个实验来判断两种看法是否正确.这些方案中可行的是(选填序号字母)______.
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化.
查看习题详情和答案>>

还可选用的药品:浓硝酸、3mol?L-1稀硝酸、蒸馏水、浓硫酸、足量氢氧化钠溶液
已知:
①浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此可得出浓硝酸的氧化性强于稀硝酸的结论.
②氢氧化钠溶液不与NO反应,但能与NO2发生反应,生成NaNO3与NaNO2
(1)加药品时,若已知③中装的是稀硝酸,为了达到探究目的,并避免实验过程有害气体排放到空气中,则还应在装置②、④、⑥中依次加入的药品是______、______、______.
(2)滴加浓硝酸之前,应打开弹簧夹a,通入N2一段时间,目的是______.关闭弹簧夹a后,还应进行的操作是______,然后再打开弹簧夹b,滴加浓硝酸.
(3)写出装置①中发生反应的化学方程式______.
(4)装置②的作用是______.装置⑥的作用是______(用离子方程式表示).
(5)该小组得出探究结论所依据的实验现象是______.
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下4个实验来判断两种看法是否正确.这些方案中可行的是(选填序号字母)______.
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化.