摘要:氧化还原反应:4FeS2+11O2=2Fe2O3+8SO2(FeS2中Fe元素的化合价为+2价)中.还原剂是 .还原产物是 .被氧化的元素是 .反应中电子转移总数为 .
网址:http://m.1010jiajiao.com/timu3_id_161074[举报]
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾.为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品.请按要求回答下列问题:
(1)工业制备硫酸时硫铁矿燃烧的设备是
(2)将尾气通入氨水中,能发生多个反应,写出其中可能发生的任意一个氧化还原反应的化学方程式:
(3)能用于测定硫酸尾气中SO2含量的是
A.NaOH溶液、酚酞试液
B.KMn04溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
(4)在制各硫酸的过程中,对废液、废热和废渣的处理正确的是:.
a.污水用石灰乳处理
b.废渣用来造水泥、炼铁
c.设置“废热”锅炉产生蒸气来供热或发电.
查看习题详情和答案>>
(1)工业制备硫酸时硫铁矿燃烧的设备是
沸腾炉
沸腾炉
,反应的化学方程式为4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
.
| ||
(2)将尾气通入氨水中,能发生多个反应,写出其中可能发生的任意一个氧化还原反应的化学方程式:
2(NH4)2SO3+O2═2(NH4)2SO4或2NH4HSO3+O2═2NH4HSO4;
2(NH4)2SO3+O2═2(NH4)2SO4或2NH4HSO3+O2═2NH4HSO4;
.(3)能用于测定硫酸尾气中SO2含量的是
BC
BC
.(填字母)A.NaOH溶液、酚酞试液
B.KMn04溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
(4)在制各硫酸的过程中,对废液、废热和废渣的处理正确的是:.
a.污水用石灰乳处理
b.废渣用来造水泥、炼铁
c.设置“废热”锅炉产生蒸气来供热或发电.
A、B、C、D、G 都是含有同一种短周期元素的化合物,E 是氧化物,H 是单质.根据如图转化关系(反应条件及部分产物已略去)填空:

( l )若A、B、C、D、G 均含X 元素,且A的一个分子中只含有10 个电子,G 是复合肥料,则反应①、②、③是工业生产
( 2 )若A、B、C、D、G 均含Y元素,Y元素处于X的相邻周期、相邻族,G 可作净水剂,则反应①、②、③是工业生产
查看习题详情和答案>>

( l )若A、B、C、D、G 均含X 元素,且A的一个分子中只含有10 个电子,G 是复合肥料,则反应①、②、③是工业生产
硝酸
硝酸
的基本原理,M 的化学式是K
K
.其中反应①的化学方程式是4NH3+5O2
4NO+6H20
| ||
| △ |
4NH3+5O2
4NO+6H20
;反应④的离子方程式是
| ||
| △ |
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.( 2 )若A、B、C、D、G 均含Y元素,Y元素处于X的相邻周期、相邻族,G 可作净水剂,则反应①、②、③是工业生产
硫酸
硫酸
的基本原理,M 元素在周期表中的位置是第3周期ⅢA族
第3周期ⅢA族
.其中反应①的化学方程式是4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
;反应①一⑤中,既属于化合反应又属于非氧化还原反应的是
| ||
③
③
.(2010?杭州学军中学第3次月考)有三种说法:
①NH4NO3中氮元素显+5价;
②4FeS2+11O2-→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等.
这三种说法中错误的是( )
①NH4NO3中氮元素显+5价;
②4FeS2+11O2-→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等.
这三种说法中错误的是( )
查看习题详情和答案>>
请把符合要求的化学反应方程式的编号填入括号内:
(1)既属于分解反应又是氧化还原反应的是
(2)属于化合反应,但不是氧化还原反应的是
(3)既属于化合反应,又是氧化还原反应的是
(4)属于分解反应,但不是氧化还原反应的是
(5)不属于四种基本反应类型的氧化还原反应的是
A.2NaHCO3=Na2CO3+CO2+CO2↑
B.2Na+Cl2=2NaCl
C.Zn+CuSO4=ZnSO4+Cu
D. 2KMnO4
K2MnO4+MnO2+O2↑
E.CaO+CO2=CaCO3
F. 4FeS2+11O2
2Fe 2O3+8SO2.
查看习题详情和答案>>
(1)既属于分解反应又是氧化还原反应的是
D
D
;(2)属于化合反应,但不是氧化还原反应的是
E
E
;(3)既属于化合反应,又是氧化还原反应的是
B
B
;(4)属于分解反应,但不是氧化还原反应的是
A
A
;(5)不属于四种基本反应类型的氧化还原反应的是
F
F
;A.2NaHCO3=Na2CO3+CO2+CO2↑
B.2Na+Cl2=2NaCl
C.Zn+CuSO4=ZnSO4+Cu
D. 2KMnO4
| ||
E.CaO+CO2=CaCO3
F. 4FeS2+11O2
| ||
(10分)黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2
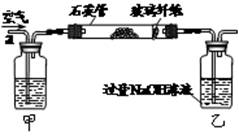
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。
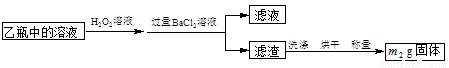
[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。

问题讨论:
(1)上述装置中,甲瓶内所盛试剂是 溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为 。
II中除了可以用H2O2溶液作为氧化剂,还可以加入 (填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填) (填“合理“或”不合理“)、 (如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有 。
查看习题详情和答案>>