摘要:(1)已知:4Fe3+ + 2H2O Fe2+ + 4H+ + O2↑每生成32gO2.电子转移的物质的量为 (2)如右图所示.用烧瓶收集CO2气体.在瓶内有一只扎紧在玻璃管末端的气球.打开塞子.迅速往瓶内加入Na2O2立即塞紧塞子.一段时间后.可观察到的现象为 . (3)氯气是有毒的.曾被法西斯制成毒气用于侵略战争.当这种毒气弹顺风爆炸时.通常可用的防御方法是 A:人.畜躲在 的地方. B:可用 浸湿软布蒙面.(从①肥皂水 ②尿 ③石灰水 ④纯碱水 ⑤NaOH溶液.填序号). (4)有F-.Cl-.I-.Br2.I2五种粒子.其中氧化性最强的是 ,还原性最强的是 .用离子方程式来表示这两种粒子间所发生的反应 .
网址:http://m.1010jiajiao.com/timu3_id_160930[举报]
已知:
(2)
(3)
甲苯及其卤代物是有机化工的基本原料,由它出发可制造某些香料、药物及广泛应用于印刷、电子工业中感光树脂的重要中间体,它们之间的关系如下所示.

根据信息回答问题:
(1)写出有机物的结构简式:A
 、C
、C
 .
.
(2)甲苯与ClΡ反应生成 的反应条件是
的反应条件是
(3)反应Ⅰ的反应类型是
(4)完成C→J的化学方程式: +CH3OH
+CH3OH
 +H2O
+H2O +CH3OH
+CH3OH
 +H2O.
+H2O.
(5)写出与C互为同分异构体且官能团相同的同分异构体的结构简式: 、
、 、
、
 、
、 、
、 .
.
查看习题详情和答案>>

(2)

(3)

甲苯及其卤代物是有机化工的基本原料,由它出发可制造某些香料、药物及广泛应用于印刷、电子工业中感光树脂的重要中间体,它们之间的关系如下所示.

根据信息回答问题:
(1)写出有机物的结构简式:A




(2)甲苯与ClΡ反应生成
 的反应条件是
的反应条件是光照
光照
.(3)反应Ⅰ的反应类型是
氧化反应
氧化反应
,反应Ⅱ的反应类型是酯化反应
酯化反应
.(4)完成C→J的化学方程式:
 +CH3OH
+CH3OH| 浓H2SO4 |
| △ |
 +H2O
+H2O +CH3OH
+CH3OH| 浓H2SO4 |
| △ |
 +H2O
+H2O(5)写出与C互为同分异构体且官能团相同的同分异构体的结构简式:
 、
、 、
、
 、
、 、
、
(2012?和平区一模)铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是
常用的处理方法有两种.
方法1:还原沉淀法
该法用FeSO4将以Cr2O72-的形式存在于酸性废水中的铬元素还原为Cr3+,再用沉淀法进行分离.已知:
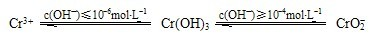
(2)FeSO4还原Cr2O72-的离子方程式为
(3)Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为
(4)沉淀法分离废水中的Cr3+离子,pH应控制在
(5)下列关于铬及其化合物的说法中正确的是
a.K2Cr2O7是-种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(6)用Fe做电极的原因为
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
查看习题详情和答案>>
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是
重金属离子会使蛋白质变性
重金属离子会使蛋白质变性
.常用的处理方法有两种.
方法1:还原沉淀法
该法用FeSO4将以Cr2O72-的形式存在于酸性废水中的铬元素还原为Cr3+,再用沉淀法进行分离.已知:
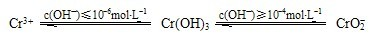
(2)FeSO4还原Cr2O72-的离子方程式为
Cr2O72-+6Fe2++14H+=3Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=3Cr3++6Fe3++7H2O
.(3)Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为
Cr3++4OH-=CrO2-+2H2O
Cr3++4OH-=CrO2-+2H2O
.(4)沉淀法分离废水中的Cr3+离子,pH应控制在
8~10
8~10
范围内.(5)下列关于铬及其化合物的说法中正确的是
abc
abc
.a.K2Cr2O7是-种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(6)用Fe做电极的原因为
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
.(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
2H++2e-=H2↑
2H++2e-=H2↑
.溶液中同时生成的沉淀还有Fe(OH)3
Fe(OH)3
.录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3+x)的化合物.已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价.则x值为
查看习题详情和答案>>
1
1
,铁的化合价+3
+3
,钴的化合价+2
+2
.日本核泄漏中最危险的是131I,它能引发甲状腺癌.但127I却是人体必需的.
(1)下列有关碘的描述中,正确的是 .
A.
I、
I、
I、
I是四种相同的核素
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I.碘盐含127I为30mg?kg-1,成人一次摄入碘盐约3kg才有预防效果.所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射
(2)向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
①b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 .
②已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 .
(3)①已知反应:2 BrO
+I2=2IO
+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由: .
②n(KBrO3)=4时,对应含碘物质的化学式为 .
(4)含x mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 .
查看习题详情和答案>>
(1)下列有关碘的描述中,正确的是
A.
126 53 |
127 53 |
128 53 |
131 53 |
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I.碘盐含127I为30mg?kg-1,成人一次摄入碘盐约3kg才有预防效果.所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射

(2)向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
①b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为
②已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式
(3)①已知反应:2 BrO
- 3 |
- 3 |
②n(KBrO3)=4时,对应含碘物质的化学式为
(4)含x mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为
 两种不同的空间异构体.下列各物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体.下列各物质中,能形成类似上述两种空间异构体的是( )