摘要:23.将过量的二氧化碳气体通入苛性钾溶液中.然后将反应后的溶液分成三份.分别加入硝酸.石灰水.氯化钙溶液.能反应的写出离子方程式.不能反应的说明理由. ① ② ③
网址:http://m.1010jiajiao.com/timu3_id_160808[举报]
将过量的二氧化碳分别通入:①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液④饱和Na2CO3溶液 ⑤澄清的石灰水.最终溶液中有白色沉淀析出的是( )
| A、①②③④⑤ | B、②④ | C、①②③⑤ | D、②③④ |
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料.新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备.(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后过滤分离;
③调节滤液pH值为6.5~7.2,然后加入NH4HCO3,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰.
工业流程图如下:

已知生成氢氧化物的pH如下表:
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有
(2)由图可知,副反应MnSO4+SO2 MnS2O6的△H
MnS2O6的△H
(3)步骤②中加入MnO2和通入空气的作用
(4)③中控制温度为60~70℃,温度不宜太高的原因是
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是
查看习题详情和答案>>
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后过滤分离;
③调节滤液pH值为6.5~7.2,然后加入NH4HCO3,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰.
工业流程图如下:

已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
(1)“浸锰”后所得混合液中主要存在的金属阳离子有
Mn2+、Fe2+、Al3+
Mn2+、Fe2+、Al3+
.(2)由图可知,副反应MnSO4+SO2
 MnS2O6的△H
MnS2O6的△H<
<
0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是150℃
150℃
.(3)步骤②中加入MnO2和通入空气的作用
加入MnO2是为了除去过量的SO2;通入空气将Fe2+氧化成Fe3+便于后来加碳酸钠除去
加入MnO2是为了除去过量的SO2;通入空气将Fe2+氧化成Fe3+便于后来加碳酸钠除去
.(4)③中控制温度为60~70℃,温度不宜太高的原因是
防止NH4HCO3受热分解
防止NH4HCO3受热分解
.(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是
综合利用了尾气SO2有利于环境保护,同时节约能源
综合利用了尾气SO2有利于环境保护,同时节约能源
(写两点).如图1为长式周期表的一部分,其中的编号代表对应的元素.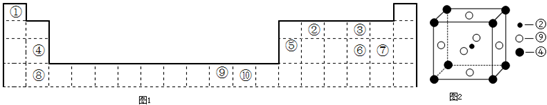
请回答下列问题:
(1)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示).
(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是 .
A.分子中含有分子间氢键 B.属于含有极性键的非极性分子
C.只含有4个σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(3)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为: ;反应过程中的离子方程式为 .
(4)比较③,⑤,⑥,⑦,⑧五种元素的电负性大小,由小到大排列的顺序为 (用元素符号表示).
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,求该金属的密度为 g?cm-3.(该金属原子的质量为a g)
查看习题详情和答案>>

请回答下列问题:
(1)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有分子间氢键 B.属于含有极性键的非极性分子
C.只含有4个σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(3)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为
(4)比较③,⑤,⑥,⑦,⑧五种元素的电负性大小,由小到大排列的顺序为
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,求该金属的密度为
(2012?梧州模拟)某同学将一定量的二氧化碳气体通入到500mL 0.3mol/L的氢氧化钠溶液中,将试液分为二等份,然后设计实验验证溶液的成分,实验记录如下:
请你对该同学的实验作出评论,填入下表(实验结论是否正确,并说明理由).
原试液的成份为
查看习题详情和答案>>
| 序号 | 操 作 | 现 象 | 结 论 |
| ① | 在第一份溶液中取少量放入试管中,滴加几滴酚酞溶液. | 溶液变红 | 溶液中一定有氢氧化钠 |
| ② | 将第二份溶液放入试管中,加入足量澄清石灰水. | 生成白色沉淀 | 溶液中一定有碳酸钠 |
| ③ | 将②所得溶液过滤,将固体洗涤、干燥、称重 | 沉淀质量5克 | 原来通入的CO2气体体积在标况下为2.24L |
| 序号 | 结论是否正确 | 理 由 |
| ① | 不正确 不正确 |
因为碳酸钠或碳酸氢钠水解,溶液显碱性,也能使酚酞变红 因为碳酸钠或碳酸氢钠水解,溶液显碱性,也能使酚酞变红 |
| ② | 不正确 不正确 |
因为碳酸氢钠也能与石灰水反应生成沉淀,可能是碳酸氢钠 因为碳酸氢钠也能与石灰水反应生成沉淀,可能是碳酸氢钠 |
| ③ | 正确 正确 |
碳酸钙质量5g,根据C原子守恒,二氧化碳为0.05mol,标况下为1.12L 碳酸钙质量5g,根据C原子守恒,二氧化碳为0.05mol,标况下为1.12L |
0.05mol碳酸钠和0.05mol碳酸氢钠
0.05mol碳酸钠和0.05mol碳酸氢钠
(写出溶质的名称和物质的量)