网址:http://m.1010jiajiao.com/timu3_id_160641[举报]
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为
υ(N2)(正)
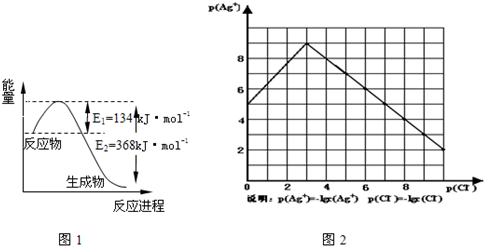
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种.请根据所学化学知识回答下列问题:
Ⅰ、已知0.01 mol/L的NaHCO3溶液呈碱性.
(1)
该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:①________
②________
③________
.(2)
溶液中共有________种不同的粒子(指分子和离子).(3)该溶液中的离子浓度由大到小的顺序是:________.
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式:________.
Ⅱ、有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol·L-1,其c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1 L、V2 L、V3 L,其大小关系为________.
(2)若三种溶液的pH都为2,分别取10 mL上述溶液加水稀释至1000 mL,此时三种溶液的pH1、pH2、pH3之间的关系为________(用“<”、“>”或“=”表示,pH1-代表盐酸、pH2-代表硫酸、pH3-代表醋酸)
Ⅲ、已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
且在25℃时,AgCl的K sp=1.8×10-10.现将足量AgCl固体分别放入下列液体中:
①100 mL蒸馏水
②100 mL0.3 mol/L AgNO3溶液
③100 mL0.1 mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为________(填序号),溶液②中c(Cl-)=________.

请回答下列问题:
(1)在磨口玻璃塞成分中含物质H,在实验室保存碱液
(2)标准状况下,11.2L气体单质B溶于NaOH溶液中,转移的电子数目为
(3)写出化学式:化合物C
(4)写出图中下列序号的离子方程式:
反应④
反应⑤
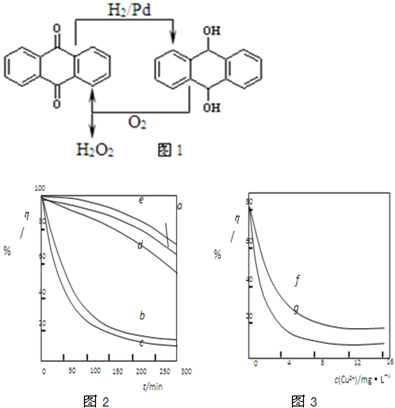
(1)已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在.在25℃下,向0.1L0.002mol?L-l的NaCl溶液中加入0.1L0.002mol?L-l硝酸银溶液,有白色沉淀生成,产生沉淀的原因是(通过计算回答)
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是
电解
A.BaO2+H2SO4=BaSO4↓+H2O2
B.2NH4HSO4
| ||
(NH4)2S2O8+2H2O=2NH4HSO4+H2O2
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
D.乙基蒽醌法见图1
(3)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图2、图3所示.注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg?L-1的条件下进行.图2中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图3中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关).
由上述信息可知,下列叙述错误的是
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小.
 (2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.(1)氯元素的原子结构示意图为


(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物.制备ClO2的方法有以下两种:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O…①
2NaClO2+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O …②
你认为哪种方法最佳
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
| ||
| ||
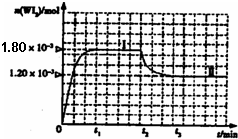
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点.一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)
的密闭容器中,加热使其反应.如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1.则:
①该反应的△H
②从反应开始到t1时间内的平均反应速率v(I2)=
| 0.036 |
| t1 |
| 0.036 |
| t1 |
③下列说法中不正确的是
A.该反应的平衡常数表达式是K=
| [WI2] |
| [W][I2] |
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ/mol
②Ti(s)+2Cl2(g)=TiCl4(l)△H=-770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式