网址:http://m.1010jiajiao.com/timu3_id_160358[举报]

(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_______________________,实验中若有mg铜参加了反应,则有
________mol硫酸被________(填“氧化”或“还原”),电子转移数目为________。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是________________________。
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。
实际上,以上方案一、二均不可取,请你说出原因?
方案一:________________________________;
方案二:________________________________;
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)________。

(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式: __________________________________,实验中若有mg铜参加了反应,则有_________mol硫酸被________(填“氧化”或“还原”),电子转移数目为_______mol。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是__________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是 _________________________________________________________________。
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。实际上,以上方案一、二均不可取,请你说出原因?
方案一 ;
方案二 。
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL) _________________________。
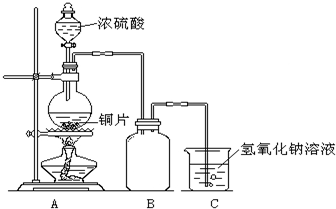
某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:

请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:
______________________________________________________________________,
实验中若有m g铜参加了反应,则有___________mol硫酸被氧化,电子转移数目为_______mol。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是__________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
_________________________________________________________________ _。(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。
实际上,以上方案一、二均不可取,请你说出原因?
方案一 ;
方案二 。
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL) _________________________ _。
查看习题详情和答案>>请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:______,
实验中若有mg铜参加了反应,则有______mol硫酸被______(填“氧化”或“还原”),转移电子的物质的量为______mol.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是______(填写字母编号).
A.硫酸钠溶液B.氯化钡溶液C.银粉D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是______
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为VL(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一______;
方案二______.
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)______.
(Ⅰ)甲取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则样品①合金中镁的质量分数为_____________。
(Ⅱ)乙取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g。则样品②合金中镁的质量分数为_____________。
(Ⅲ)丙取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是____________________________________________。
(Ⅳ)丁取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
求:(1)该盐酸的物质的量浓度。
(2)样品④中合金中镁的质量分数。
(3)在c组实验后,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?