网址:http://m.1010jiajiao.com/timu3_id_160271[举报]
硼酸在玻璃制造和医药领域应用广泛。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式: 。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)![]() [B(OH)4]–(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4]–(aq)+H+(aq) K=5.7×10–10(298K)
①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。
写出硼酸与NaOH反应的离子方程式 。
②计算25℃时0.7mol·L–1 硼酸溶液中H+的浓度。(写出计算过程,结果保留小数后一位)
(3)已知298K时:
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10—7 K2=4.7×10—11 | K=1.75×10—5 |
下列说法正确的是 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
查看习题详情和答案>>碳族元素是形成化合物种类最多的元素。
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10 b.11 c.13 d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是 (选填序号)。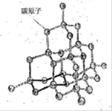
a.C-C键键角都为109°28’ b.最小的环由6个C原子构成
c.可溶于非极性溶剂 d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10 b.11 c.13 d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是 (选填序号)。
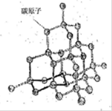
a.C-C键键角都为109°28’ b.最小的环由6个C原子构成
c.可溶于非极性溶剂 d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
(13分)
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO 和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
(2) Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4-中不存在__________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
并写出一种与 CN_ 互为等电子体的单质分子式______________________。
③三氯化铁常温下为固体,熔点,沸点
,在
:以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。
(3)①Ti的在周期表中位置______________ 。
根据元素原子的外电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为 。工业上利用X和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐),制备M的化学反应方程式是________________________________________;
查看习题详情和答案>>
(13分)
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO 和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN) 是一种链状分子,它与异氰酸(HNCO)互为同分异构体
是一种链状分子,它与异氰酸(HNCO)互为同分异构体 ,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
(2) Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4-中不存在__________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
并写出一种与 CN_ 互为等电子体的单质分子式______________________。
③三氯化铁常温下为固体,熔点 ,沸点
,沸点 ,在
,在  :以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。
:以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。
(3)①Ti的在周期表中位置______________ 。
根据元素原子的外电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为 。工业上利用X和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐),制 备M的化学反应方程式是________________________________________;
备M的化学反应方程式是________________________________________;