摘要:14.用密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中.直到沉淀恰好完全为止.已知 所生成的溶液的质量等于原BaCl2溶液的质量.则H2SO4溶液的浓度为 ( ) A.21.9% B.42.1% C.13.5mol/L D.5.67mol/L
网址:http://m.1010jiajiao.com/timu3_id_159699[举报]
用密度为1.32g·cm-3的硫酸溶液,逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为
[ ]
A.21.9%
B.42.1%
C.13.5mol·L-1
D.5.67mol·L-1
 新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此重拳治理酒驾是因为酒后驾车是引发交通事故的重要原因.如图为交警对驾驶员是否饮酒进行检测.其原理如下:
新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此重拳治理酒驾是因为酒后驾车是引发交通事故的重要原因.如图为交警对驾驶员是否饮酒进行检测.其原理如下:2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O
根据上述信息回答问题
(1)该反应中被检测的成分为
CH3CH2OH
CH3CH2OH
,该反应的氧化剂是CrO3
CrO3
,还原产物是Cr2(SO4)3
Cr2(SO4)3
,此反应可用于检测驾驶员是否是酒后驾车的原因是检测剂颜色由红色变为绿色,颜色变化明显,易于观察
检测剂颜色由红色变为绿色,颜色变化明显,易于观察
(2)实验室需要用密度为1.84g?cm-3、质量分数为98%的浓硫酸配制1.0mol?L-1的硫酸100mL,量取浓硫酸时需要用到量筒最好选用
C
C
A.50mL B.20mL C.10mL D.100mL.
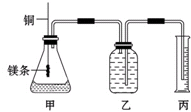 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:Ⅰ.(1)配制浓度均为0.50mol?L-1 H2SO4和H2C2O4溶液;
(2)用
(3)分别称取除去表面氧化膜的镁条并系于铜丝末端;
(4)检查装置的气密性,在广口瓶中装满水,按图连接好装置;
(5)将铜丝向下移动,使足量镁条浸入酸中(铜丝不能与酸接触),至反应完全,记录
(6)反应结束后,读取量筒中水的体积为y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84g?cm-3 98%的浓硫酸配制250mL 0.50mol?L-1的H2SO4溶液,所需要的主要仪器有
(2)以下是读取量筒内水的体积时必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是
(4)简述速率不等的原因是