摘要:3.化学键的破坏 ①化学反应过程中反应物中的化学键被破坏.如H2+F2====2HF.H-H.F-F键均被破坏. ②对离子化合物.其溶解于水后.便成为自由的阴.阳离子.离子键被破坏.其熔化后.也成为自由的阴.阳离子.离子键被破坏. ③对于共价化合物.有些共价化合物溶于水后.能与水作用.其分子内共价键被破坏.如HCl.HBr等. ④对于某些很活泼的非金属单质.溶于水后.能与水作用.其分子内共价键被破坏.如Cl2.F2等. [例1]关于化学键的下列叙述中.正确的是 A.离子化合物可能含共价键 B.共价化合物可能含离子键 C.离子化合物中只含离子键 D.共价化合物中不含离子键 [例2]下列分子的电子式书写正确的是 [例3]下列各分子中所有原子都满足最外层为8电子结构的是 A.BeCl2 B.PCl3 C.PCl5 D.N2 练习1.下列物质中.含有共价键的化合物是( ) A.碘化氢 B.烧碱 C.液溴 D.食盐 练习2.下列说法正确的是( ) A.钠原子与氯气反应生成食盐后.其结构的稳定性增强. B.阴.阳离子之间有强烈的吸引作用而没有排斥作用.所以离子键的核间距相当小. C.失电子难的原子获得电子的能力一定强. D.两个原子之间的相互作用叫化学键. 练习3.已知氢化锂(LiH)属于离子化合物.Li跟水反应可以放出H2.下列叙述中正确的是( ) A.LiH的水溶液显中性 B.LiH是一种强氧化剂 C.LiH中的氢离子可以被还原成H2 D.LiH中的氢离子与锂离子的核外电子排布相同 练习4.有A.B.C.D四种元素.A的正二价离子与氩原子的电子层结构相同.B原子有三个电子层.其单质为双原子分子.C的核外电子比A少一个.B与D同周期.其单质为淡黄色固体. (1)写出A.B.C.D的离子符号. (2)A.B.C.D的离子半径由小到大的顺序是怎样的? (3)用电子式表示这四种元素中两两形成离子化合物的过程. 练习5.据报道.美国科学家卡尔·克星斯特于1998年11月合成了一种名为“N5 的物质.由于其极强的爆炸性.又称为“盐粒炸弹 .迄今为止.人们对它的结构尚不清楚.只知道“N5 实际上是带正电荷的分子碎片.其结构是对称的.5个N排列成V形.如果5个N结合后都达到8电子结构.且含有2个N≡N叁键.则“N5 分子碎片所带电荷及其电子式如何?
网址:http://m.1010jiajiao.com/timu3_id_158828[举报]
化学键的键能是指气态原子间形成1mol化学键时释放的能量.如:H(g)+I(g)=H-I(g);△H=-297kJ?mol-1,即H-I键的键能为297kJ?mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.下表是一些键能数据.(单位:kJ?mol-1)
阅读上述信息,回答下列问题:
(1)你认为键能与物质的热稳定性的关系是:
所以CF4的化学稳定性比CCl4
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q kJ?mol-1;通过计算确定热化学方程式中Q的值为
(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:
查看习题详情和答案>>
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | C-F | 427 |
| H-N | 393 | H-O | ? | H-F | 565 |
| C-Cl | 330 | H-S | 339 | H-Cl | 431 |
| C-O | 347 | C-I | 218 | H-Br | 366 |
(1)你认为键能与物质的热稳定性的关系是:
键能越大,物质的热稳定性越强
键能越大,物质的热稳定性越强
.所以CF4的化学稳定性比CCl4
强
强
(填“强”或“差”或“相同”)(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q kJ?mol-1;通过计算确定热化学方程式中Q的值为
183
183
.(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:
原子半径越小,形成的键长越短,键长越短键能越大
原子半径越小,形成的键长越短,键长越短键能越大
.由此可推出H-O键的键能最佳估值范围为:393
393
kJ?mol-1<E(H-O)<565
565
kJ?mol-1.[化学-选修/物质结构与性质]
(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,实验表明,加热至94℃时该晶体失去结晶水,该晶体失去结晶水的过程,破坏的微粒间的主要作用力属于 .
②一种铜与金形成的合金,其晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子的数目之比为 .
(2)下表为元素周期表的一部分,根据此表回答下列问题:
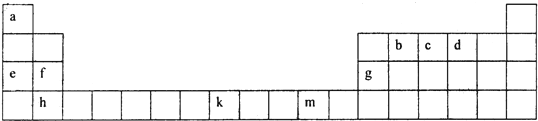
①f、g、h三种元素的第一电离能由小到大的顺序是 (用元素符号表示),b、c、d三种元素的电负性由大到小的顺序是 (用元素符号表示),b、c、d分别与a形成的简单化合物分子中,属于含有极性键的非极性分子是 .(填写化学式)
②有一种元素x和上表中所列元素k位于同周期、同一族且不相邻的位置,请写出元素x原子的基态价电子排布式 .
目前,利用金属或合金作为储氢材料的研究取得很大进展,如图是一种La-x合金储氢后的晶胞结构图.该合金储氢后,含有lmol La(镧)的合金中吸附的H2的数目为 .
③科学家把由c、d、e组成的离子化合物ecd 3和e2d在一定条件下反应得到一种白色晶体,该晶体中的阴离子为cd
,其中各原子的最外层电子均满足8电子稳定结构.该阴离子的中心原子的杂化轨道方式为 杂化,阴离子的电子式为 .
查看习题详情和答案>>
(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,实验表明,加热至94℃时该晶体失去结晶水,该晶体失去结晶水的过程,破坏的微粒间的主要作用力属于
②一种铜与金形成的合金,其晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子的数目之比为
(2)下表为元素周期表的一部分,根据此表回答下列问题:

①f、g、h三种元素的第一电离能由小到大的顺序是
②有一种元素x和上表中所列元素k位于同周期、同一族且不相邻的位置,请写出元素x原子的基态价电子排布式

目前,利用金属或合金作为储氢材料的研究取得很大进展,如图是一种La-x合金储氢后的晶胞结构图.该合金储氢后,含有lmol La(镧)的合金中吸附的H2的数目为
③科学家把由c、d、e组成的离子化合物ecd 3和e2d在一定条件下反应得到一种白色晶体,该晶体中的阴离子为cd
3- 4 |
化学键的键能是指气态原子间形成1mol化学键时释放的能量.如:H(g)+I(g)=H-I(g);△H=-297kJ?mol-1,即H-I键的键能为297kJ?mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.下表是一些键能数据.(单位:kJ?mol-1)
阅读上述信息,回答下列问题:
(1)你认为键能与物质的热稳定性的关系是:______.
所以CF4的化学稳定性比CCl4______(填“强”或“差”或“相同”)
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q kJ?mol-1;通过计算确定热化学方程式中Q的值为______.
(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:______.由此可推出H-O键的键能最佳估值范围为:______kJ?mol-1<E(H-O)<______kJ?mol-1.
查看习题详情和答案>>
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | C-F | 427 |
| H-N | 393 | H-O | ? | H-F | 565 |
| C-Cl | 330 | H-S | 339 | H-Cl | 431 |
| C-O | 347 | C-I | 218 | H-Br | 366 |
(1)你认为键能与物质的热稳定性的关系是:______.
所以CF4的化学稳定性比CCl4______(填“强”或“差”或“相同”)
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q kJ?mol-1;通过计算确定热化学方程式中Q的值为______.
(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:______.由此可推出H-O键的键能最佳估值范围为:______kJ?mol-1<E(H-O)<______kJ?mol-1.
化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H―1(g),△H=-297kJ/mol即H―I键的键能为297kJ?mol―1,也可以理解为破坏1molH―I键需要吸收297kJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。下表是一些键能数据(kJ?mol―1)
| 键能 | 键能 | 键能 | 键能 | ||||
| H H | 436 | C1―C1 | 243 | H―C1 | 432 | H―O | 464 |
| S=S | 255 | H―S | 339 | C―F | 427 | C―O | 347 |
| C―C1 | 330 | C―1 | 218 | H―F | 565 | N≡N | 941 |
回答下列问题:
(1)由表中数据能不能得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大) (填“能”或“不能”)
②非金属性越强的原子形成的共价键越牢固 (填“能”或“不能”)
(2)能否从数据找出一些规律,请写出一条 。
(3)由热化学方程式H2(g)+C12(s)→2H2S(g);△H=―185kJ?mol―1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是 。
(4)由热化学方程式2H2(g)+S2(s)→2H2S(g);△H=―224.5kJ?mol―1种表中数值可计算出1molS2(s)气化时的△H为 。
(5)通过上表预测卤代烃RX在同样条件下发生碱性水解反应时,RF、RC1、RBr、RI(R相同)的反应活性由大到小的顺序是 。
查看习题详情和答案>>
化学键的键能是指气态原子间形成1mol化学键时释放的能量.如:H(g)+I(g)=H-I(g);△H=-297kJ?mol-1,即H-I键的键能为297kJ?mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.下表是一些键能数据.
阅读上述信息,回答下列问题:
(1)你认为键能与物质的热稳定性的关系是:______.
所以CF4的化学稳定性比CCl4______(填“强”或“差”或“相同”)
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q kJ?mol-1;通过计算确定热化学方程式中Q的值为______.
(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:______.由此可推出H-O键的键能最佳估值范围为:______kJ?mol-1<E(H-O)<______kJ?mol-1.
查看习题详情和答案>>
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | C-F | 427 |
| H-N | 393 | H-O | ? | H-F | 565 |
| C-Cl | 330 | H-S | 339 | H-Cl | 431 |
| C-O | 347 | C-I | 218 | H-Br | 366 |
(1)你认为键能与物质的热稳定性的关系是:______.
所以CF4的化学稳定性比CCl4______(填“强”或“差”或“相同”)
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q kJ?mol-1;通过计算确定热化学方程式中Q的值为______.
(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:______.由此可推出H-O键的键能最佳估值范围为:______kJ?mol-1<E(H-O)<______kJ?mol-1.
查看习题详情和答案>>