摘要: 将MgCl2和NaHCO3按物质的量1∶2的比例混合制成溶液. 再加热蒸干得到的固体是 A. Mg(HCO3)2和NaCl B. Mg(OH)2和NaCl C. MgCl2和Na2CO3 D. MgCO3和NaCl
网址:http://m.1010jiajiao.com/timu3_id_158603[举报]
某研究小组探究将MgCl2和AlCl3混合溶液加入到氢氧化钠溶液中生成沉淀及沉淀溶解的情况,实验过程中可能用到的仪器与药品如下:过滤装置,烧杯,滴管,0.5mol?L-1 MgCl2、AlCl3各100mL,1mol?L-1 NaOH溶液,1mol?L-1盐酸.
探究一:实验开始时产生沉淀的成分
[假设一]实验开始时产生的沉淀是Mg(OH)2
[假设二]
[假设三]实验开始时产生的沉淀是Al(OH)3和Mg(OH)2
基于假设二成立,请利用下表完成实验过程:
探究二:何时产生氢氧化镁沉淀
请用离子方程式表示上述实验步骤③的结论:
查看习题详情和答案>>
探究一:实验开始时产生沉淀的成分
[假设一]实验开始时产生的沉淀是Mg(OH)2
[假设二]
实验开始时产生的沉淀是Al(OH)3
实验开始时产生的沉淀是Al(OH)3
[假设三]实验开始时产生的沉淀是Al(OH)3和Mg(OH)2
基于假设二成立,请利用下表完成实验过程:
| 实验步骤 | 预期实验现象 | 预期实验结论 |
分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 |
无现象 无现象 |
溶液中水解不能生成沉淀 溶液中水解不能生成沉淀 |
向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 |
当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 |
产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 |
将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 |
滤渣全部溶解 滤渣全部溶解 |
产生的沉淀只有氢氧化铝 产生的沉淀只有氢氧化铝 |
空 空 |
空 空 |
空 空 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①另取0.5mol?L-1 MgCl2、AlCl3溶液各30mL于不同烧杯中 | 溶液中无现象 溶液中无现象 |
水溶液中无氢氧化镁、氢氧化铝沉淀生成 水溶液中无氢氧化镁、氢氧化铝沉淀生成 |
| ②向0.5mol?L-1 AlCl3溶液中逐滴加入NaOH溶液至刚好反应完全 | 产生沉淀,沉淀溶解,沉淀消失 | 产生氢氧化铝沉淀,加过量的氢氧化钠溶液后氢氧化铝又溶解 |
| ③将MgCl2溶液全部倒入②反应后的溶液中 | 产生大量白色沉淀 | 二者混合时相互促进水解最终生成Mg(OH)2和Al(OH)3沉淀. 二者混合时相互促进水解最终生成Mg(OH)2和Al(OH)3沉淀. |
2AlO2-+Mg2++4H2O═Mg(OH)2↓+2Al(OH)3↓
2AlO2-+Mg2++4H2O═Mg(OH)2↓+2Al(OH)3↓
.下列关于某些物质(离子)的检验方法或结论不正确的是( )
| A、向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | B、利用NaOH溶液可以鉴别Na2SO4、MgCl2和Fe2(SO4)3三种溶液 | C、向某溶液中加入NaOH溶液后再加热,若能产生使湿润红色石蕊试纸变蓝的气体,则该溶液中肯定有NH4+ | D、利用焰色反应可以将NaCl、KCl二种无色溶液区别开来 |
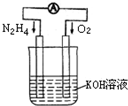 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:
N2H4+O2=N2+2H2O,若将此反应设计成如右图所示的原电池装置,请回答:
①负极反应式为:
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
;②工作一段时间后正极附近溶液的pH变化为
增大
增大
(填“增大”“减小”或“不变”);③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为
0.5 mol?L-1
0.5 mol?L-1
.(2)在25℃时,向浓度均为0.1mol?L-1的MgCl2和CuCl2 混合溶液中逐滴加入氨水,首先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3?H20=Cu(OH)2↓+2NH4+
Cu2++2NH3?H20=Cu(OH)2↓+2NH4+
.(已知25℃Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20).(3)在25℃时,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”“碱”或“中”),用含a的代数式表示NH3?H2O的电离常数kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
 如图所示,把试管放入盛有25℃澄清饱和石灰水的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中.试回答下列问题:(提示:Ca(OH)2溶解度随着温度的升高而减小)
如图所示,把试管放入盛有25℃澄清饱和石灰水的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中.试回答下列问题:(提示:Ca(OH)2溶解度随着温度的升高而减小)(1)实验中观察到的现象有
镁条上有气泡产生,镁条逐渐溶解,石灰水变浑浊
镁条上有气泡产生,镁条逐渐溶解,石灰水变浑浊
.(2)产生上述实验现象的原因是
Mg+2HCl=MgCl2+H2↑该反应是放热反应,体系温度升高使Ca(OH)2溶解度降低而产生沉淀
Mg+2HCl=MgCl2+H2↑该反应是放热反应,体系温度升高使Ca(OH)2溶解度降低而产生沉淀
.(3)写出有关的离子反应方程式
Mg+2H+=Mg2++H2↑
Mg+2H+=Mg2++H2↑
.(4)由实验可知,MgCl2和H2的总能量
小于
小于
(填“大于”、“小于”或“等于”)镁条和盐酸的总能量.(5)如将本题中“25℃澄清饱和石灰水”换成“20℃的碳酸饮料”进行探究实验,实验中观察到的另一现象是
小试管外壁上(或烧杯内)有气泡产生
小试管外壁上(或烧杯内)有气泡产生
.其原因是温度升高降低CO2溶解度而放出CO2气体
温度升高降低CO2溶解度而放出CO2气体
.下列说法正确的是( )
| A、铅蓄电池是最常见的二次电池,正极板上覆盖有铅 | B、25℃时,将20mL 0.1mol/L的H2SO4溶液和30mL 0.1mol/L的NaOH溶液混合,则混合溶液的pH>7 | C、向2mL浓度均为 1mol/L的MgCl2和FeCl3混合溶液中滴加2滴1mol/L的NaOH溶液,立即看到白色沉淀 | D、浓度均为0.1mol/L的CH3COOH和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |