网址:http://m.1010jiajiao.com/timu3_id_158531[举报]
(11分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:
已知:H2(g)+1/2O2(g)=H2O(g)
 H= −241.8kJ/mol
H= −241.8kJ/mol
C(s)+1/2O2(g)=CO(g)  H= −110.5kJ/mol
H= −110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
△H=−a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mo1 SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4mo1 O2 D.6mo1 SO2和4mo1 O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)
 H>0
H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D. N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
 H>0,
H>0,
简述该设想能否实现的依据 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)  CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
。
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
。
查看习题详情和答案>>
(11分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:
已知:H2(g)+1/2O2(g)=H2O(g)  H= ?241.8kJ/mol
H= ?241.8kJ/mol
C(s)+1/2O2(g)=CO(g)  H= ?110.5kJ/mol
H= ?110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
△H=?a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mo1 SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4mo1 O2 D.6mo1 SO2和4mo1 O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D. N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)  H>0,
H>0,
简述该设想能否实现的依据 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)  CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 。
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 。
(1)将煤转化为清洁气体燃料:
已知:H2(g)+1/2O2(g)=H2O(g)
 H= ?241.8kJ/mol
H= ?241.8kJ/mol C(s)+1/2O2(g)=CO(g)
 H= ?110.5kJ/mol
H= ?110.5kJ/mol写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)
 2SO3(g);
2SO3(g);△H=?a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mo1 SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4mo1 O2 D.6mo1 SO2和4mo1 O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)
2NO(g)  H>0
H>0在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D. N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
 H>0,
H>0,简述该设想能否实现的依据 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)
 CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 。
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 。(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ的热量,生成1 mol N三N键放出942 kJ的热量,请写出N4转变为N2的反应的热化学方程式:___。
(2)已知NH3在氧气中燃烧可生成N2和水。据报道,NH3可直接用作车用碱性燃料电池,写出该电池的负极反应式:____。
(3)已知:温度低于21.15 ℃时,NO2几乎全部转变为N2O4。工业上可用N2O4与水反应来提高硝酸的产率。N2O4与氧气在冷水中生成硝酸的化学方程式为___。
(4)工业上可用Na2CO3溶液吸收NO2,该反应的化学方程式为2NO2+Na2CO3=NaNO2+___ +____。
(5)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50 mol/L、 c(N2O4) =0.125 mol/L。则该条件下2NO2(g)
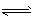 N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。
N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。 开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=??????? ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA???? tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:???????????????????????????????????? 。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是????????? ? ,曲线Ⅱ对应的实验条件改变是??????? 。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]

①下列说法中正确的是????? 。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是????? (填晶体类型)。
查看习题详情和答案>>