网址:http://m.1010jiajiao.com/timu3_id_157959[举报]
 向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:
向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:2A(g)?-2B(g)+C(?),5min后反应达到平衡,测得平衡后容器内的压强和开始时相同,B在混合气体中所占的体积分数是80%,反应吸收的热量是56Kj.请填写下列空白:
(1)该温度下,下列叙述可以说明该反应已达平衡状态的是
①V(A)=v(B)②v正(A)=v逆(B)
③A、B的物质的量相等④C的物质的量不再变化
⑤混合气体的平均相对分子质量不再变化⑥混合气体的密度不再变化
⑦混合气体的总物质的量不再变化
(2)该温度下,此反应的化学平衡常数为
(3)该反应的热化学反应方程式为
已知:该条件下产物C不为液态).
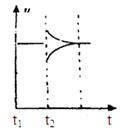
(4)在该温度下的速率时间图象中,假设第6min时将容器体积从2L变为1L,请在右图中补画出该反应的速率随时间的变化情况.
(5)保持恒温容,在原平衡体系中再充入3molA,平衡将
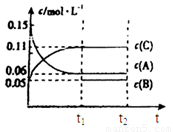
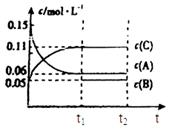
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。
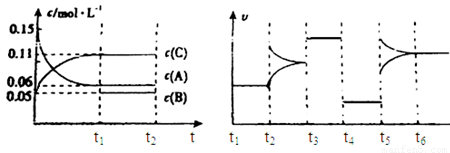
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)= mol/(L∙s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正 v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为 mol;
(4)t1时刻,平衡常数K= ;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式 ;
(6)若t2时刻后图像变化如下图,则改变条件为
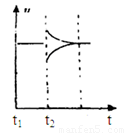
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
查看习题详情和答案>>
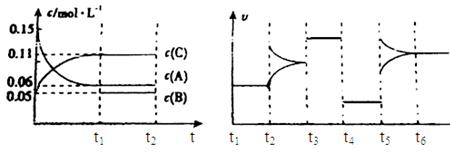
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。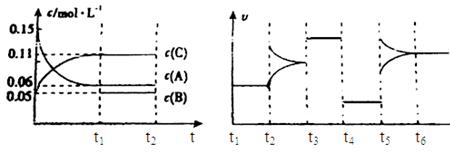
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)= mol/(L?s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正 v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为 mol;
(4)t1时刻,平衡常数K= ;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式 ;
(6)若t2时刻后图像变化如下图,则改变条件为 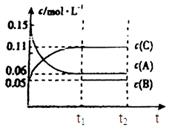
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)= mol/(L?s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正 v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为 mol;
(4)t1时刻,平衡常数K= ;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式 ;
(6)若t2时刻后图像变化如下图,则改变条件为
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
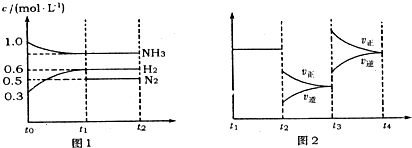
(1)能证明反应达到平衡状态的是
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl=15s,则t0-t1阶段以H2浓度变化表示的反应速率为
(3)t3-t4阶段改变的条件为
(4)上述反应的平衡常数K=
(5)25℃时,将a mol?L-1的氨水与0.1mol?L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3?H2O的电离常数Kb=
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |