摘要:硅的化学性质 (1)在常温下化学性质很稳定.常温下发生的反应: Si+2F2====SiF4 Si+4HF====SiF4↑+2H2↑ Si+2NaOH+H2O====Na2SiO3+2H2↑ △ (2)在加热条件下与O2反应 Si+O2=====SiO2 高温 6.工业制法 SiO2+2C======Si+2CO↑ 思考:(1)该反应中.氧化剂是 .还原剂是 .碳置换硅跟“碳的非金属性比硅强 是否矛盾? (2)列举几例同一主族元素单质间的置换反应.
网址:http://m.1010jiajiao.com/timu3_id_157912[举报]
下列有关物质性质应用的说法正确的是
| A.SO2具有漂白性,可用作熏蒸粉丝使其增白 |
| B.常温下二氧化硅不与强酸反应,可用石英容器盛放氢氟酸 |
| C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀 |
| D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等[来源:学科 |
【三选一—选修化学与技术】
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。
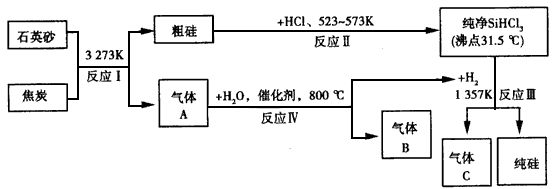
请回答下列问题(各元素用相应的元素符号表示)。
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni( A)4在423K时分解的化学方程式___。
查看习题详情和答案>>
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni( A)4在423K时分解的化学方程式___。
下列有关物质性质应用的说法正确的是
- A.SO2具有漂白性,可用作熏蒸粉丝使其增白
- B.常温下二氧化硅不与强酸反应,可用石英容器盛放氢氟酸
- C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
- D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等[来源:学科
四种短周期元素的性质或结构信息如表所示,请根据信息回答下列问题:
(1)B在元素周期表中的位置是第
 .
.
(2)写出C单质与水反应的化学方程式:
(3)D的最高价氧化物晶体的硬度
(4)A、B两元素非金属性较强的是(写元素符号)
查看习题详情和答案>>
| 元素 | A | B | C | D |
| 性质或结构信息 | 室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧发出明亮的蓝紫色火焰 | 单质在常温、常压下是气体,能溶于水;原子的M层比L层少1个电子 | 单质为质软、银白色固体,导电性强;单质在空气中燃烧发出黄色火焰 | 原子的最外电子层上电子数比内层电子总数少6;单质为空间网状晶体,具有很高的熔沸点 |
三
三
周期ⅦA
ⅦA
族,写出A原子的原子结构示意图:

(2)写出C单质与水反应的化学方程式:
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.A与C形成的化合物溶于水后,溶液的pH大于
大于
7(填“大于”、“等于”或“小于”).(3)D的最高价氧化物晶体的硬度
大
大
(填“大”或“小”),其理由是二氧化硅属于原子晶体
二氧化硅属于原子晶体
.(4)A、B两元素非金属性较强的是(写元素符号)
Cl
Cl
;写出能证明这一结论的实验事实:高氯酸的酸性比硫酸酸性强
高氯酸的酸性比硫酸酸性强
.(2008?上海)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)B元素在周期表中的位置
(2)写出C单质与水反应的化学方程式
(3)D元素最高价氧化物晶体的硬度
(4)A、B两元素非金属性较强的是(写元素符号)
查看习题详情和答案>>
| 元素 | A | B | C | D |
| 性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化. 单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
单质常温、常压下是气体,能溶于水. 原子的M层有1个未成对的p电子. |
单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. |
原子最外层电子层上s电子数等于p电子数. 单质为空间网状晶体,具有很高的熔、沸点. |
第三周期ⅦA
第三周期ⅦA
,写出A原子的电子排布式1s22s22p63s23p4
1s22s22p63s23p4
.(2)写出C单质与水反应的化学方程式
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.A与C形成的化合物溶于水后,溶液的pH>
>
7(填“大于”、“等于”或“小于”).(3)D元素最高价氧化物晶体的硬度
小(或大)
小(或大)
(填“大”、“小”),其理由是二氧化碳是分子晶体(或二氧化硅是原子晶体)
二氧化碳是分子晶体(或二氧化硅是原子晶体)
.(4)A、B两元素非金属性较强的是(写元素符号)
Cl
Cl
.写出证明这一结论的一个实验事实高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强
高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强
.