摘要:(二)浓硫酸 1.物理性质 纯硫酸是一种 色 状 体.常用的浓硫酸中H2SO4的质量分数为 .若其密度为 1.84 g·cm-3.则其物质的量浓度为 mol·L-1.硫酸是一种高沸点 挥发的 酸. 于水.能以 比与水混溶.浓硫酸溶解时放出大量的热. 思考:(1)稀释浓硫酸应特别注意:① ,② .浓硫酸与其他液体相互混合时也一定要注意上述两点. 微热 (2)实验室制取HCl气体的化学反应方程式为: NaCl(s)+H2SO4(浓)======NaHSO4+HCl↑.这是利用了浓硫酸的 性质. 2.特性 ①吸水性 将一瓶浓硫酸敞口放置在空气中.其质量将 .密度将 .浓度 .体积 .这是因为浓硫酸具有 性.利用这一性质在实验室里硫酸常用来 . 浓硫酸不仅可以吸收空气中的水.还可吸收混在气体中的水蒸气.混在固体中的湿存水.结晶水合物中的部分结晶水. 思考:(1)若将一瓶浓盐酸露置在空气中.可能会发生怎样的变化呢? (2)不能用浓硫酸干燥的气体有 .简述原因. (3)实验室常用浓盐酸跟浓硫酸混合来快速简易制取HCl气体.请简述原因. ②脱水性 浓硫酸 浓硫酸可以使有机化合物中的氢氧元素按水的组成从有机物中“脱离 出来.结合成水分子. 如:C12H22O11 12C+11H2O 说明:有机物被浓H2SO4脱去水并不一定都生成碳. 思考:(1)将浓H2SO4滴到干燥的蓝色石蕊试纸上.可能发生什么现象? ③强氧化性 A.跟金属反应 a.常温下.浓硫酸能使 等金属钝化. b.加热时.浓H2SO4可以与除金.铂之外的所有金属反应.生成高价金属硫酸盐.本身一般被还原成SO2. △ 完成下列反应.标出电子转移的方向和数目. △ Cu+H2SO4(浓) Fe+H2SO4(浓) 在上述反应中.硫酸表现出了 . 思考: (1)金属与浓硫酸反应为什么不放出H2? 中.浸有碱液棉花的作用是什么? (3)2 mol浓硫酸跟足量金属铜反应能生成 1 mol SO2吗? (4)浓硫酸的强氧化性源于+6价硫.在稀H2SO4中也有+6价硫.为什么稀H2SO4跟金属反应都放出H2? B.跟非金属反应 热的浓H2SO4可将碳.硫.磷等非金属单质氧化到其高价态的氧化物或含氧酸.本身被还原为SO2.在这类反应中浓H2SO4只表现氧化性.写出上述三个化学方程式: 说明:(1)S被浓H2SO4氧化.只能变成+4价而不会变成+6价 (2)C.S.P等非金属单质被氧化成氧化物还是含氧酸.取决于含氧酸的稳定性.如H2CO3.H2SO3遇热均易分解.而H3PO4却很稳定. 思考:(1)把炽热的木炭投入热浓H2SO4中会放出气体.怎样检验生成了SO2和CO2气体? (2)蔗糖与浓H2SO4的脱水实验中.为什么会闻到刺激性气味? *C.跟其他还原性物质反应 浓H2SO4具有强氧化性.实验室制取H2S.HBr.HI等还原性气体.不能选用浓H2SO4. △ H2S+H2SO4(浓)====S+SO2+2H2O △ 2HBr+H2SO4(浓)====Br2+SO2+2H2O 2HI+H2SO4(浓)===== I2+SO2+2H2O 浓H2SO4还能跟其他还原剂发生反应.在今后将陆续学习.
网址:http://m.1010jiajiao.com/timu3_id_157908[举报]
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气
B
B
(2)浓硫酸使木条变黑
C
C
(3)热的浓硫酸与铜片反应
AD
AD
Ⅱ.现用该浓硫酸配制100mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管; ②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒; ⑧100mL容量瓶.请回答:
(1)配制稀硫酸时,上述仪器中不需要使用的有
②④⑥
②④⑥
(选填序号).(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为
5.4
5.4
mL.(3)下列操作会使配制的溶液浓度偏高的是
B
B
A.量取浓H2SO4时,俯视刻度线
B.定容时,俯视容量瓶刻度线
C.配制前,容量瓶中有水珠
D.定容后摇匀发现液面下降而未向其中再加水.
用18mol?L-1 浓硫酸配制100mL 3.0mol?L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是
A.10mL B.25mL C.50mL D.100mL).
(2)第③步实验的操作是
(3)第⑤步实验的操作是
(4)第④步实验操作的目的是
(5)溶液转移到容量瓶之前需要恢复到室温是因为
(6)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.定容时加蒸馏水不慎超过了刻度
查看习题详情和答案>>
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是
16.7mL
16.7mL
,量取浓硫酸所用的量筒的规格是B
B
(从下列中选用A.10mL B.25mL C.50mL D.100mL).
(2)第③步实验的操作是
把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,不断用玻璃棒搅拌散热
把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,不断用玻璃棒搅拌散热
(具体操作方法).(3)第⑤步实验的操作是
继续向容量瓶加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀
继续向容量瓶加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀
(具体操作方法).(4)第④步实验操作的目的是
尽可能将溶质全部移入容量瓶中
尽可能将溶质全部移入容量瓶中
.(5)溶液转移到容量瓶之前需要恢复到室温是因为
影响溶液体积,易造成容量瓶炸裂
影响溶液体积,易造成容量瓶炸裂
.(6)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中
偏小
偏小
B.容量瓶用蒸馏洗涤后残留有少量的水
无影响
无影响
C.所用过的烧杯、玻璃棒未洗涤
偏小
偏小
?D.定容时俯视刻度线
偏大
偏大
?E.定容时加蒸馏水不慎超过了刻度
偏小
偏小
?I.(1)对下列仪器:
A.移液管 B.蒸馏烧瓶 C.滴定管 D.量筒
E.容量瓶 F.蒸发皿 G.分液漏斗 E.吸滤瓶
①使用时必须检查是否漏水的有
②使用前必须用待盛液润洗的有
(2)如图各种尾气吸收装置中,适合于吸收NH3气体,而且能防止倒吸的有
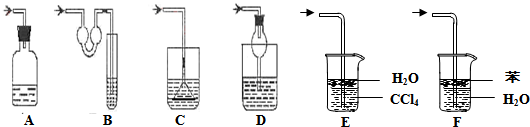
Ⅱ.某课题小组同学测量液态奶含氮量的实验过程如下:
实验原理:
(NH4)2SO4溶液液态奶辅助试剂加热吹出NaOHNH3吸收H3BO3(NH4)2B4O7溶液用标准盐酸滴定
实验步骤:
①在烧杯中加入10.00mL液态奶和辅助试剂,加热充分反应;
②将反应液转移到大试管中;
③按如图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
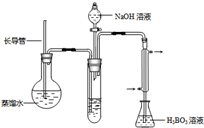 ④取下锥形瓶,滴加指示剂,用0.1000mol?L-1盐酸标准液滴定;
④取下锥形瓶,滴加指示剂,用0.1000mol?L-1盐酸标准液滴定;
⑤重复测定两次,再用10.00mL蒸馏水代替液态奶进行上述操作.
数据记录如下:
回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为
(2)步骤③的实验装置中需要加热的仪器是
(3)设计4号空白对照实验的目的是
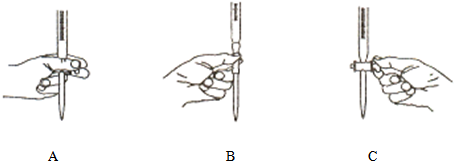
(4)本实验④中操作滴定管的以下图示中,正确的是
(5)计算该液态奶的含氮量为
查看习题详情和答案>>
A.移液管 B.蒸馏烧瓶 C.滴定管 D.量筒
E.容量瓶 F.蒸发皿 G.分液漏斗 E.吸滤瓶
①使用时必须检查是否漏水的有
C、E、G
C、E、G
(填序号)②使用前必须用待盛液润洗的有
A、C
A、C
(填序号)(2)如图各种尾气吸收装置中,适合于吸收NH3气体,而且能防止倒吸的有
B、D、E
B、D、E
.
Ⅱ.某课题小组同学测量液态奶含氮量的实验过程如下:
实验原理:
(NH4)2SO4溶液液态奶辅助试剂加热吹出NaOHNH3吸收H3BO3(NH4)2B4O7溶液用标准盐酸滴定
实验步骤:
①在烧杯中加入10.00mL液态奶和辅助试剂,加热充分反应;
②将反应液转移到大试管中;
③按如图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
 ④取下锥形瓶,滴加指示剂,用0.1000mol?L-1盐酸标准液滴定;
④取下锥形瓶,滴加指示剂,用0.1000mol?L-1盐酸标准液滴定;⑤重复测定两次,再用10.00mL蒸馏水代替液态奶进行上述操作.
数据记录如下:
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 1 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55 |
| 3 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 4 | 10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸 | 1.50 |
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为
(NH4)2B4O7+2HCl+5H2O=4H3BO3+2NH4Cl
(NH4)2B4O7+2HCl+5H2O=4H3BO3+2NH4Cl
.(2)步骤③的实验装置中需要加热的仪器是
圆底烧瓶
圆底烧瓶
(填仪器名称),长导管的作用是防止装置中压力过大而发生危险;防止冷却时发生倒吸
防止装置中压力过大而发生危险;防止冷却时发生倒吸
.(3)设计4号空白对照实验的目的是
消除其他试剂、实验操作等因素引起的误差
消除其他试剂、实验操作等因素引起的误差
.(4)本实验④中操作滴定管的以下图示中,正确的是
A
A
(填编号).
(5)计算该液态奶的含氮量为
4.480
4.480
mg?mL-1.(保留四位有效数字) 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气
B
B
(2)浓硫酸使木条变黑
C
C
(3)热的浓硫酸与铜片反应
AD
AD
Ⅱ.现用该浓硫酸配制100mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有
②④⑥
②④⑥
(选填序号),还缺少的仪器有玻璃棒、容量瓶
玻璃棒、容量瓶
(写仪器名称);(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为
5.4ml
5.4ml
mL(保留一位小数),量取浓硫酸时应选用①
①
(选填①10mL、②50mL、③100mL)规格的量筒.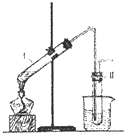 如图是实验室制溴乙烷的装置示意图,在试管Ⅰ中依次加入2ml蒸馏水、4mL浓硫酸、4mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,反应结束.
如图是实验室制溴乙烷的装置示意图,在试管Ⅰ中依次加入2ml蒸馏水、4mL浓硫酸、4mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,反应结束.