网址:http://m.1010jiajiao.com/timu3_id_157899[举报]
[提出问题]Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
[实验探究]取适量Na2S2O4晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A. 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 |
a.溶液pH=8 | i. S2O32-+H2O?HS2O3-+OH- S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b. 有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 |
ii.S2O32一+2H+═ S↓+SO2↑+H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii. S2O32-+4C12+5H2O=2SO42-+8C1-+10H+ S2O32-+4C12+5H2O=2SO42-+8C1-+10H+ |
探究②:
[问题讨论]
(1)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案是否正确并说明理由
(2)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化.你的方案
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 217 | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)碲的化合价可能有
(2)氢硒酸有较强的
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
(4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:
(5)右图所示为上述表格中氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热.则:b代表
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液k+s-5#u ![]()
③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
查看习题详情和答案>>某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:

(1)已知:2H2O2(aq) = 2 H2O (l)
+ O2(g) 的 < 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
< 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃ 时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括号内填写催化剂的化学式)金属Pt 催化下,H2O2分解的反应速率v(O2) = mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度T,重复上述实验。获得V(O2) ~ T关系曲线。下列趋势图最可能符合实测V(O2) ~ T关系曲线的是 ,原因是 。

(A) (B) (C) (D)
(4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极 ;阳极 。
查看习题详情和答案>>
下表是氧族元素的相关性质
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | ―218.4 | 113 | 450 | |
| 单质沸点(℃) | ―183 | 444.6 | 685 | 1390 |
| 主要化合价 | ―2 | ―2,+4,+6 | ―2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是
(2)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生在化学反应方程式为 。
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
□Al2Te3+□ ===Al(OH)3↓+□H2Te↑
(4)已知在常温下,H2和S反应生成17gH2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式: 。
(5)右图所示为氧族元素单质与H2反应过程中的
能量变化示意图,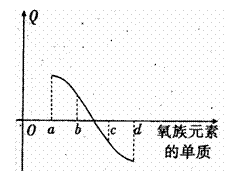 其中a、b、c、d分另表示
其中a、b、c、d分另表示
氧族中某一元素的单质,Q为相同物质的量
的单质与H2反应放出的热量。则:
a代表 ,c代表
(均可单质名称)
查看习题详情和答案>>