网址:http://m.1010jiajiao.com/timu3_id_157890[举报]
硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为
(2)硅主要以硅酸盐、
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
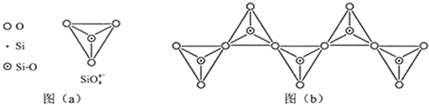
(6)在硅酸盐中,SiO
4- 4 |
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:CH3COONa+NaOH
| △CaO |
①X属于
②MgO晶体的熔点比CaO高,主要原因是
(2)金刚石和石墨是两种重要的碳单质.以Ni-Cr-Fe为催化剂,一定条件下可将石墨转化为金刚石.基态Cr3+离子中未成对电子数有
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2H2O=8Ag↓+SiO2↓+8HNO3该反应中氢元素被氧化,由此可判断电负性:Si
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是

A.碳、硅 B.硅、硫? C.碳、硫 D.氧、氮?
查看习题详情和答案>>
两种元素甲、乙最高正价和负价绝对值相同,其主要同位素原子核内质子数与中子数相等。甲在其最简单气态氢化物中占75.0%,乙在其气态氢化物中占87.5%。甲、乙是( )?
A.碳、硅 B.硅、硫?
C.碳、硫 D.氧、氮?
查看习题详情和答案>>碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于 晶体(填晶体类型)。
②MgO晶体的熔点比CaO高,主要原因是 。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
(3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的
是 (填标号)。
查看习题详情和答案>>