网址:http://m.1010jiajiao.com/timu3_id_157161[举报]

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶.
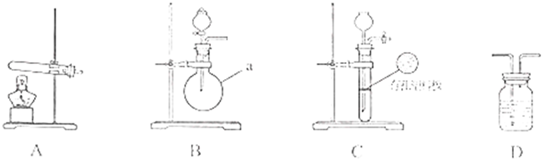
甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1L.
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2L.
请回答下列问题:
(1)写出仪器a的名称:
(2)检查A装置气密性的操作时
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
| 实验装置 | 实验药品 | 制备原理 | |||||||||
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① (NH4)2SO4+Ca(OH)2
(NH4)2SO4+Ca(OH)2
| ||||||||
| 乙小组 | ② B B |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 |
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是

下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
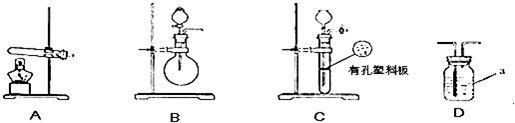
实验开始前装置中的空气已排尽.甲小组测得:反应前氧化铜的质量为m1g、氧化铜反应后剩余固体的质量为m2g、生成氮气在标准状况下的体积V1L.乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积.
(1)写出仪器a的名称:
(2)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因可能是
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果.该药品的名称是
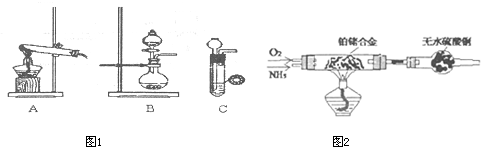
(1)甲、乙两小组选择了不同方法制(图1)取氨气,请将实验装置的字母编号和制备原理填写在下表空
格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO
| ||
 查看习题详情和答案>>
查看习题详情和答案>>
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ①??????????????????????????????? |
乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③??????????????????????????????? |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____??????????????????????????????????????? ,硬质玻璃管中氨发生催化氧化反应的化学方程式为????????????????????????? 。

(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?????????????????????? ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有???????????????????? 。
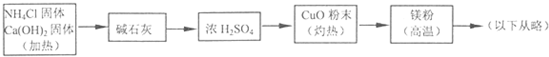
??? (4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。

查看习题详情和答案>>
甲.乙两个研究性学习小组为测定氨分子中氮.氢原子个数比,设计了如下实验流程:

下图A.B.C为甲.乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

实验开始前装置中的空气已排尽。甲小组测得:反应前氧化铜的质量为 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积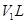 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
(1)写出仪器a的名称: 。
(2)甲.乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
|
|
实验装置 |
实验药品 |
制备原理 |
|
甲小组 |
A |
氢氧化钙.硫酸铵 |
反应的化学方程式为 ① |
|
乙小组 |
② |
浓氨水.氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③
|
(3)甲小组用所测数据计算出氨分子中氮.氢的原子个数之比为 。
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮.氢的原子个数比明显小于理论值,其原因可能是 。
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果。该药品的名称是 。
查看习题详情和答案>>