摘要: 某亚硫酸钠试剂已部分被氧化,为确定其纯度要进行如下实验:①称取样品m1 g,②将样品溶解,③给溶液加入稍过量盐酸酸化的BaCl2溶液,④过滤.洗涤.干燥沉淀,称得其质量为m2 g.回答: (1)BaCl2要用盐酸酸化的原因 . (2)BaCl2溶液稍过量的目的 . 是否完成的方法是 . (4)判断沉淀是否洗净的方法是 . (5)Na2SO3纯度表示式为W(Na2SO3) . 25有A.B.C.D 4种元素.它们的原子序数由A到D逐渐增大.①D的氧化物分子式为DO2.D的最高价氧化物中.D的质量百分含量为40%.而且D的原子核中.质子数和中子数相等.②A和B原子有相同的电子层数.A原子的最外层电子数是次外层电子数的2倍,⑧B的阴离子与C的阳离子和Ne原子的电子层结构相同.通常状况下.B的单质是气体.0.1摩B和H2完全反应时.有2.408x1023个电子转移.C的单质在高温下与B的单质充分反应.可生成浅黄色固体.此生成物与AB2反应可生成B的单质.根据以上叙述试回答: (1)指出四种元素的名称:A .B .C .D . (2) 写出AB2的结构式 ;分子空间构型 .AB2晶体俗名叫 ,是 晶体 (3)电子式表示B.C在高温下化合的过程
网址:http://m.1010jiajiao.com/timu3_id_156654[举报]
某亚硫酸钠试剂已部分被氧化.为确定它的纯度,要进行如下实验:①称取样品W1 g;②将样品溶解;③给溶液加入稍过量盐酸酸化了的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2 g.试回答:
(1)BaCl2要用盐酸酸化的原因是________.
(2)BaCl2溶液要稍过量的原因是________.
(3)判断操作③是否完成的方法是________.
(4)判断沉淀是否洗净的方法是________.
(5)Na2SO3的纯度表达式为________.
查看习题详情和答案>>
某亚硫酸钠试剂已部分被氧化。为确定它的纯度,要进行如下实验:
①称取样品W1g;
②将样品溶解;
③给溶液加入稍过量盐酸酸化了的BaCl2溶液;
④过滤、洗涤、干燥沉淀,称其质量为W2g。试回答:
(1)BaCl2要用盐酸酸化的原因是________。
(2)BaCl2溶液要稍过量的原因是________。
(3)判断操作③是否完成的方法是________。
(4)判断沉淀是否洗净的方法是________。
(5)Na2SO3纯度表示式为________________。
查看习题详情和答案>>
某亚硫酸钠试剂已部分被氧化。为确定它的纯度,要进行如下实验:
①称取样品W1g;
②将样品溶解;
③给溶液加入稍过量盐酸酸化了的BaCl2溶液;
④过滤、洗涤、干燥沉淀,称其质量为W2g。试回答:
(1)BaCl2要用盐酸酸化的原因是________。
(2)BaCl2溶液要稍过量的原因是________。
(3)判断操作③是否完成的方法是________。
(4)判断沉淀是否洗净的方法是________。
(5)Na2SO3纯度表示式为________________。
查看习题详情和答案>>
 ;②将样品溶解;③给溶液加入稍过量盐酸酸化了的
;②将样品溶解;③给溶液加入稍过量盐酸酸化了的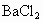 溶液;④过滤、洗涤、干燥沉淀,称其质量为
溶液;④过滤、洗涤、干燥沉淀,称其质量为 .试回答:
.试回答: 纯度的表示式为________.
纯度的表示式为________.