摘要:P102.7 105.9 111.3 115.17 116.6 130.4 132.2 133.11 134.7 136.61.质量数为37的原子.应该有 ( ) A .18个质子.19个中子.19个电子 B.17个质子.20个中子.18个电子 C.19个质子.18个中子.20个电子 D. 18个质子.19个中子.18个电子
网址:http://m.1010jiajiao.com/timu3_id_156294[举报]
海水中不仅含有丰富的非金属元素资源,(如Cl,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: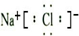
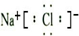 ;与Na,Cl同周期,且简单离子半径最小的离子结构示意图:
;与Na,Cl同周期,且简单离子半径最小的离子结构示意图:
(2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:①溶解,②
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体.
有关资料:
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,则最佳试剂选择和操作是:
①先加
②再加
③过滤后,为能得到纯净MgCl2晶体,采用的操作方法是:
查看习题详情和答案>>
(1)海水晒盐的原理是:
蒸发结晶
蒸发结晶
;写出氯化钠的电子式: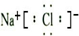
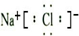
(2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:①溶解,②
加过量氯化钡溶液
加过量氯化钡溶液
,③加过量Na2CO3溶液,④加过量氢氧化钠溶液
加过量氢氧化钠溶液
.⑤过滤除去杂质,⑥加稀盐酸于滤液中至酸性
加稀盐酸于滤液中至酸性
,⑦蒸发结晶;(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体.
有关资料:
| M(OH)n | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mg(OH)2 | 9.5 | 11.0 |
| Cr(OH)3 | 4.3 | 5.0 |
①先加
H2O2
H2O2
;目的是将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
;②再加
MgO
MgO
;目的是调节溶液PH至5.0<PH<9.5,使杂质离子完全沉淀
调节溶液PH至5.0<PH<9.5,使杂质离子完全沉淀
,③过滤后,为能得到纯净MgCl2晶体,采用的操作方法是:
加盐酸,在酸性环境蒸发结晶,防止水解
加盐酸,在酸性环境蒸发结晶,防止水解
.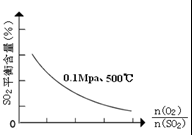 (1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)
| 催化剂 |
| △ |
0~4min时,容器气体压强为101KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①
②第5min时,从速率和转化率两个方面分析,改变的外界条件是
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比
| n(O2) |
| n(SO2) |
| n(O2) |
| n(sO2) |
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol?L-1的H2C2O4溶液滴加0.01mol?L-1KOH溶液V(mL),回答下列问题.
①当V<10mL时,反应的离子方程式为
②当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4);则a
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O42-)的值将
回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如图所示.
根据上图所示步骤并参考表格数据,回答下列问题.
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式: .
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是 .

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是 .
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是 .
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为 .
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为 .
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 .
查看习题详情和答案>>

根据上图所示步骤并参考表格数据,回答下列问题.
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为
卤块的主要成分是MgCl2,此外还含有少量的Fe3+、Fe2+和Mn2+等离子.以卤块为原料制取轻质氧化镁工艺以及相关数据如下:

常温下生成氢氧化物沉淀的pH数据:回答下列问题:
(1)加入NaClO后产生少量红褐色沉淀.写出加入NaClO后发生的离子反应方程式:
(2)为尽量除去杂质,用NaOH调节pH.当溶液pH为
(3)流程图中操作X是
(4)加入Na2CO3后,加水煮沸的化学方程式为
查看习题详情和答案>>

| 物 质 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
(1)加入NaClO后产生少量红褐色沉淀.写出加入NaClO后发生的离子反应方程式:
3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
.(2)为尽量除去杂质,用NaOH调节pH.当溶液pH为
9.8
9.8
时,停止加入NaOH.(3)流程图中操作X是
过滤、洗涤、灼烧
过滤、洗涤、灼烧
.(4)加入Na2CO3后,加水煮沸的化学方程式为
MgCO3+H2O
Mg(OH)2+CO2↑
| ||
MgCO3+H2O
Mg(OH)2+CO2↑
.向除去Fe3+、Fe2+和Mn2+等离子后的滤液中改加Na2CO3,而不继续加入NaOH,你认为可能的原因是
| ||
使用NaOH的生产成本大
使用NaOH的生产成本大
.富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物.某校研究性学习小组通过查阅大量资料后,决定自行制备富血铁并检测其含铁量.
富马酸(HOOC-CH=CH-COOH)的性质:
Fe2+的性质:
Ⅰ、富马酸亚铁的制备
①将适量的富马酸置于100mL烧杯中,加水20mL在热沸搅拌下,加入Na2CO3溶液10mL,使其pH为6.5~6.7;
②将上述溶液转移至100mL圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30mL,维持温度100℃,充分搅拌1.5小时.
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末.
试回答:
步骤①中加入Na2CO3,反应的离子方程式 (富马酸及其酸根用化学式表示).
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是 .若反应后溶液的pH太大则引起的后果是 .
Ⅱ、产品纯度测定
准确称取富血铁0.3200g,加煮沸过的3mol/LH2SO4溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000mol/L标准溶液进行滴定.直至溶液刚好变为浅蓝色即为终点.测得其体积为18.50mL,计算样品中富血铁的质量分数,写出计算过程.(Fe2++Ce4+═Fe3++Ce3+) .
查看习题详情和答案>>
富马酸(HOOC-CH=CH-COOH)的性质:
| 分子式 | 相对分子质量 | 溶解度和溶解性 | 酸性 |
| H4C4O4 | 116 | 在水中:0.7g(25℃)、9.8g(97.5℃). 盐酸中:可溶. |
二元酸,且0.1mol/L H4C4O4的pH=2. |
| 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.6 |
①将适量的富马酸置于100mL烧杯中,加水20mL在热沸搅拌下,加入Na2CO3溶液10mL,使其pH为6.5~6.7;
②将上述溶液转移至100mL圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30mL,维持温度100℃,充分搅拌1.5小时.
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末.
试回答:
步骤①中加入Na2CO3,反应的离子方程式
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是
Ⅱ、产品纯度测定
准确称取富血铁0.3200g,加煮沸过的3mol/LH2SO4溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000mol/L标准溶液进行滴定.直至溶液刚好变为浅蓝色即为终点.测得其体积为18.50mL,计算样品中富血铁的质量分数,写出计算过程.(Fe2++Ce4+═Fe3++Ce3+)