网址:http://m.1010jiajiao.com/timu3_id_155680[举报]
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 |
|
|
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是________________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2―→2O b. O+H2O―→2OH c. OH+OH―→H2O2
(4) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(5) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
(6) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为____________。
(7) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
查看习题详情和答案>>
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 | | |
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是________________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。

Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2―→2O b. O+H2O―→2OH c. OH+OH―→H2O2
(4) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(5) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
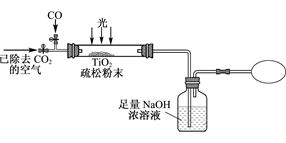
Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
(6) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为___
 _________。
_________。(7) 当CO气体全部通入后,还要通一会儿空气,其目的是 。 查看习题详情和答案>>
纳米材料二氧化钛(TiO2)可做优良的催化剂。
|
资料卡片 |
|
|
|
物质 |
熔点/℃ |
沸点/℃ |
|
SiCl4 |
-70 |
57.6 |
|
TiCl4 |
-25 |
136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是________________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2―→2O b. O+H2O―→2OH c. OH+OH―→H2O2
(4) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(5) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。

Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
(6) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为____________。
(7) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
查看习题详情和答案>>
工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO?Cr2O3、还含有Al2O3、SiO2)。某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7)。实验流程为:
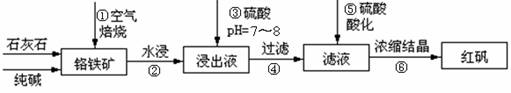
已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO?Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在_______(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器____。
(2)步骤③用硫酸将溶液的pH调至7~8,目的是 ;
并写出有关的离子方程式 。
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为 。
(4)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。②③④的实验操作方法分别是_______________。
| 序号 | 实验操作方法 | 实验操作过程 |
| ① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌 |
| ② | 将所得溶液沿玻璃棒引流至蒸发皿中,边加热边用玻璃棒搅拌溶液,使NaC1结晶析出 | |
| ③ | 趁热将NaC1晶体与溶液分离 | |
| ④ | 冷却滤液使K2Cr2O7析出 | |
| ⑤ | 过滤 | 得到K2Cr2O7晶体 |
纳米材料二氧化钛(TiO2)可做优良的催化剂.

Ⅰ.工业上二氧化钛的制备方法:
①将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
②将SiCl4分离,得到纯净的TiCl4.
③在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O.
④TiO2·xH2O高温分解得到TiO2.
(1)根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_________,分离二者所采取的操作名称是_________.
(2)③中反应的化学方程式是_________.
(3)若④在实验室完成,应将TiO2·xH2O放在_________(填仪器名称)中加热.
Ⅱ.据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2→2O
b.O+H2O→2OH
c.OH+OH→H2O2
(4)b中破坏的是_________(填“极性共价键”或“非极性共价键”).
(5)H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的_________(填“氧化性”或“还原性”).

Ⅲ.某研究性学习小组用下列装置模拟“生态马路”清除CO的原理.(夹持装置已略去)
(6)若缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5 g,则CO的转化率为_________.
(7)当CO气体全部通入后,还要通一会儿空气,其目的是_________.