摘要:5g/mol·x/1l+29g/mol·/1L=34.6g/mol. 解得 x=0.75L 故答案为C. 答案:C 例3 有Mg.Al.Fe.Cu四种金属.若两两混合.取混合物26g与足量稀硫酸反应.产生标准状况下H211.2L.此混合物的可能组合的方式最多有( ) A.2种 B.3种 C.4种 D.5种 解析:本题不能根据化学方程式.采用排列组合的方法.设未知数讨论求解.这样运算量太大.且极易出错.此类题可用“平均摩尔电子质量法 巧解. 所谓“摩尔电子质量 是指物质得失1mol电子所需要的质量.常用Me-表示.单位为g/mole-. n(H2)===0.5mol 因为2H++2e-→H2↑.所以共得0.5mol×2=1mole-.则金属混合物必失去1mole-.故: Me-==26g/mole- 又Me-(Mg)==12g/mole- Me-(Al)==9g/mole- Me-(Fe)==28g/mole- Cu与稀H2SO4不反应.视为Me-(Cu)无限大. 根据平均值原理.混合物可能组合的方式有:Mg.Fe;Al.Fe;Mg.Cu,Al.Cu.共四种. 答案:C 例4 如果ag某气体中含有的分子数为b.则cg该气体在标准状况下体积(式中NA为阿伏加德罗常数)( ) A. L B. L C. L D. L 解析:由题知一个分子质量为.而1mol气体的质量即摩尔质量为·NA.cg该气体的物质量的量为c÷(·NA).体积为.故选A. 答案:A 例5 下列说法正确的是( ) A.1mol任何气体的体积都约是22.4L B.20℃.1.0×105Pa.同体积的O2.CO2含有相同的分子数 C.1mol气态物质.当体积为22.4L时.该气体一定处于标准状况 D.2mol气体体积约为44.8L 解析:A中缺少标准状况的条件,B根据阿伏加德罗定律.同温同压下.同体积的任何气体都含有相同的数目的分子.故B正确,C中.1mol气态物质在非标准状况时.体积也有可能等于22.4L,D中缺少标准状况条件.故选B. 答案:B 例6 氢气和氧气的混合气体.在120℃和一定压强下体积为a升.点燃后发生反应.待恢复至原来温度和压强时.测得其体积为b升.原混合气体中氢气和氧气的体积各是多少升? 解析:这是根据阿伏加德罗定律进行讨论计算型能力考查题.比较快速的解法是“差量法 . 设参加反应的H2为x升.O2为y升. 2H2+O2 = 2H2O(气) ΔV 2 1 2 1 x y a-b x=2L 讨论:(1)当H2与O2恰好完全反应时 =2(a-b)L =(a-b)L 或=aL或=bL =aL或=bL (2)当H2过量时.O2全部参加反应 =(a-b)L =a- (3)当O2过量时.H2全部参加反应 =2(a-b)L =a-2L [同步达纲练习]
网址:http://m.1010jiajiao.com/timu3_id_155324[举报]
高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂.M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团).
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为 .
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为 mol?L-1.
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL.将B投入过量烧碱溶液中,未检测出NH3的逸出.则B的化学式可表示为 .
(3)已知在图中,L的位置完全相同.现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似图.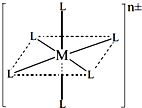
如果该配离子共有2种不同结构,该配离子的式量为 .
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2.则该盐的式量以及物质的量分别为 .
查看习题详情和答案>>
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL.将B投入过量烧碱溶液中,未检测出NH3的逸出.则B的化学式可表示为
(3)已知在图中,L的位置完全相同.现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似图.

如果该配离子共有2种不同结构,该配离子的式量为
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2.则该盐的式量以及物质的量分别为
 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下相关信息有;①反应④产生白色沉淀,且M(H):143.5g/mol;
②常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒.
③1molB含28mole-,反应③属于分解反应.
④C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为


硝酸银溶液
硝酸银溶液
.反应②离子方程式:4OH-+Al3+=AlO2-+2H2O
4OH-+Al3+=AlO2-+2H2O
.(2)写出反应③的化学方程式:
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;上述所有物质形成的晶体类型有
| ||
| △ |
分子晶体、离子晶体
分子晶体、离子晶体
(选填:分子晶体、离子晶体、原子晶体)(3)C溶液中阴离子浓度与阳离子浓度之比
大于
大于
3(填:大于、小于或等于);简述实验室用C晶体配制3mol/L的C溶液的操作方法是取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液
取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液
.(4)写出G与C溶液混合的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.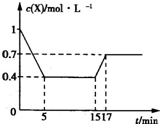 一定条件下,向一容积为1L的密闭容器中加入1 mol X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡;15min时改变某一反应条件,到17min时建立新平衡,X的物质的量浓度变化曲线如图所示.下列说法中错误的是( )
一定条件下,向一容积为1L的密闭容器中加入1 mol X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡;15min时改变某一反应条件,到17min时建立新平衡,X的物质的量浓度变化曲线如图所示.下列说法中错误的是( )