摘要:4gCuSO4中Cu2+的个数是 .硫酸根离子的物质的量为 .
网址:http://m.1010jiajiao.com/timu3_id_155239[举报]
将一定量铜与足量浓硝酸充分反应,可以得到6.72L NO2气体(气体体积在标准状况下测定).
(1)写出铜与浓硝酸反应化学方程式.标明电子转移的方向和数目.
(2)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到气体的体积为多少?
查看习题详情和答案>>
(1)写出铜与浓硝酸反应化学方程式.标明电子转移的方向和数目.
(2)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到气体的体积为多少?
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)已知可逆反应FeO(s)+CO(g)?Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
①写出该反应平衡常数的表达式
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1mol?L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01mol?L-1的下列五种物质的溶液中,酸性最强的是
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里c(Cu2+)=0.02mol?L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于
查看习题详情和答案>>
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式
K=
| c(CO2) |
| c(CO) |
K=
.| c(CO2) |
| c(CO) |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的平均相对分子质量
减小
减小
(选填“增大”、“减小”、“不变”);充入氦气,混合气体的密度增大
增大
(选填“增大”、“减小”、“不变”).(2)常温下,浓度均为0.1mol?L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
CO32-
CO32-
②根据表中数据判断,浓度均为0.01mol?L-1的下列五种物质的溶液中,酸性最强的是
D
D
(填编号);将各溶液分别稀释100倍,pH变化最小的是C
C
(填编号).A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是
CD
CD
(填编号).A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
H++HCO3-=H20+CO2↑
H++HCO3-=H20+CO2↑
(3)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里c(Cu2+)=0.02mol?L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于
5
5
;要使0.2mol?L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为6
6
.
MnSO4?H2O在工业、农业等方面有广泛的应用.
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4?H2O过程如下:
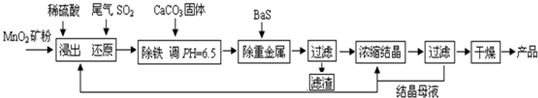
已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 .
(2)除铁发生的离子反应方程式为 .
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= mol/L.
(二):性质-热稳定性:MnSO4?H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是
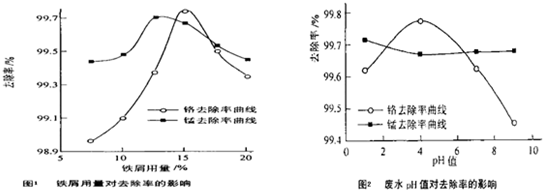
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示.则在pH一定时,废水中铁屑用量为 时锰、铬去除率最好
(2)取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如下图2所示.则在铁屑用量一定时,废水pH= 时锰、铬去除率最好
 查看习题详情和答案>>
查看习题详情和答案>>
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4?H2O过程如下:

已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是
(2)除铁发生的离子反应方程式为
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大=
(二):性质-热稳定性:MnSO4?H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示.则在pH一定时,废水中铁屑用量为
(2)取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如下图2所示.则在铁屑用量一定时,废水pH=
 查看习题详情和答案>>
查看习题详情和答案>>
用Pt电极电解500mL含KNO3和Cu(NO3)2混合溶液一段时间,在两极均生成标准状况下的气体11.2L,则电路中通过的电子的物质的量为
查看习题详情和答案>>
2
2
mol,混合液中Cu2+的物质的量浓度为1
1
mol/L.(2013?江苏二模)氧化铜矿石含有CuO和Cu2(OH)2CO3,还含有Fe2O3、FeO和SiO2等.铜、铁是畜禽所必需的微量元素.某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:
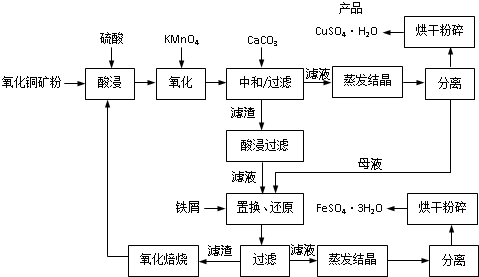
(1)氧化铜矿石粉碎的目的是
(2)写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式
(3)“中和/过滤”中加入CaCO3的目的是
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
(5)加入铁屑的作用是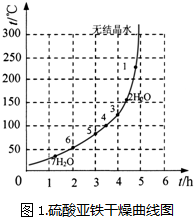
(6)表2和图1为“烘干粉碎”的试验结果.
表2.硫酸铜晶体(CuSO4?5H2O)干燥试验表
表2中,m为CuSO4?5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数.据此可确定由CuSO4?5H2O和FeSO4?7H2O脱水得流程中所示产品的适宜工艺条件分别为
查看习题详情和答案>>

(1)氧化铜矿石粉碎的目的是
增大接触面积,加快化学反应速率
增大接触面积,加快化学反应速率
.(2)写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
.(3)“中和/过滤”中加入CaCO3的目的是
适当降低溶液的酸性,使Fe3+水解成沉淀而除出
适当降低溶液的酸性,使Fe3+水解成沉淀而除出
.(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(5)加入铁屑的作用是
使母液中Fe3+转化为Fe2+、除去Cu2+
使母液中Fe3+转化为Fe2+、除去Cu2+
、提高硫酸亚铁晶体的纯度
提高硫酸亚铁晶体的纯度
.
(6)表2和图1为“烘干粉碎”的试验结果.
表2.硫酸铜晶体(CuSO4?5H2O)干燥试验表
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
160℃、3h
160℃、3h
,125(±5)℃、4.0h
125(±5)℃、4.0h
(分别指出两条件的温度和时间).