题目内容
| V |
| Vm |
| 11.2L |
| 22.4L/mol |
溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,生成0.5molO2,需电子为4×0.5mol=2mol;
阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,生成0.5molH2,需0.5mol×2=1mol电子,依据电子守恒,铜离子得到电子1mol,反应的铜离子物质的量0.5mol,所以Cu2+的物质的量浓度C=
| n |
| v |
| 0.5mol |
| 0.5L |
故答案为:2;1;

(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 gNa2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 mL | 0.02 | 24.01 |
| 2 | 25.00 mL | 0.70 | 24.71 |
| 3 | 25.00 mL | 0.20 | 24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
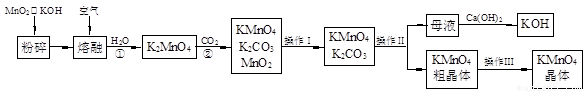
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数[来源:][来源:Z&xx&k.Com] |
待测溶液的体积/mL[来源:学#科#网Z#X#X#K] |
标准溶液的体积[来源:] |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。