摘要:4.9gH2SO4 的物质的量为 .其中所含氧原子的个数是 .
网址:http://m.1010jiajiao.com/timu3_id_155237[举报]
下列关于实验操作的叙述中正确的是( )
①从试剂瓶中取出的任何药品,若有剩余都不能再放回原试剂瓶
②可燃性气体点燃之前必须验纯
③用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中
④用托盘天平称量固体药品时,应左物右码
⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却
⑥选用100mL量筒量取4.0mL的稀硫酸.
①从试剂瓶中取出的任何药品,若有剩余都不能再放回原试剂瓶
②可燃性气体点燃之前必须验纯
③用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中
④用托盘天平称量固体药品时,应左物右码
⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却
⑥选用100mL量筒量取4.0mL的稀硫酸.
查看习题详情和答案>>
[化学-物质结构与性质]
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.原子处于基态时,A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一电离能至第四电离能(kJ/mol)分别为:
578,1817、2745、11575;E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
(1)写出A的基态核外电子排布式
(2)C2+和A2+都能与NH3、H2O等形成配位数为4的配合物.[A(NH3)4]2+和[C(NH3)4]2+都具有对称的空间构型,[C(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,而[A(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种产物,则[C(NH3)4]2+的空间构型为
(3)1mol D的单质分子中存在
(4)实验测得气态无水Q在1.01ⅹ105Pa,t1℃的密度为5.00g/L,气体摩尔体积为53.4L/mol,则此时Q的组成为(写化学式)
查看习题详情和答案>>
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.原子处于基态时,A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一电离能至第四电离能(kJ/mol)分别为:

578,1817、2745、11575;E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
(1)写出A的基态核外电子排布式
1s22s22p63s23p63d104s2
1s22s22p63s23p63d104s2
;用最简式表示B、C合金的组成CaCu5
CaCu5
用元素符号表示)(2)C2+和A2+都能与NH3、H2O等形成配位数为4的配合物.[A(NH3)4]2+和[C(NH3)4]2+都具有对称的空间构型,[C(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,而[A(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种产物,则[C(NH3)4]2+的空间构型为
平面正方形
平面正方形
.[A(NH3)4]2+中A的杂化方式为sp3
sp3
.(3)1mol D的单质分子中存在
NA
NA
个σ键NA个
NA个
π键.D的气态氢化物很容易与H+结合,C原子与H+间形成的键叫配位键
配位键
.(4)实验测得气态无水Q在1.01ⅹ105Pa,t1℃的密度为5.00g/L,气体摩尔体积为53.4L/mol,则此时Q的组成为(写化学式)
Al2Cl6
Al2Cl6
,Q属于分子
分子
晶体. (2012?西安二模)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(2012?西安二模)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.(1)Ni在元素周期表中的位置是
第四周期,第Ⅷ族
第四周期,第Ⅷ族
.(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子
CN-、C22-
CN-、C22-
.配体NH3中N原子的杂化类型为sp3
sp3
,它可用作致冷剂的原因是液态氨汽化时需吸收大量的热
液态氨汽化时需吸收大量的热
.若[Ni(NH3)6]2+ 为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有2
2
种.(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为
[Ar]3d7
[Ar]3d7
,NiO(OH)溶于浓盐酸的化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O
2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O
.(4)镍和镧(
139 57 |
5
5
.该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixHy+y NiO(OH)
| 放电 |
| 充电 |
LaNi5H6+6OH--6e-═LaNi5+6H2O
LaNi5H6+6OH--6e-═LaNi5+6H2O
.按要求回答下列问题:
(1)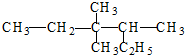 的名称为
的名称为
(2)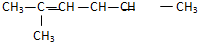 的名称为
的名称为
(3)写出 4-甲基-2-庚烯的结构简式
(4) 的分子式为
的分子式为
(5)某烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烃的结构简式为
(6)写出 C7H8O属于芳香族化合物且能发生催化氧化反应,该物质的结构简式为:
(7)根据转化关系,在横线处写出三种物质的结构简式(要求:不同类别的物质).
查看习题详情和答案>>
(1)
 的名称为
的名称为3,3,4-三甲基己烷
3,3,4-三甲基己烷
(2)
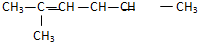 的名称为
的名称为2-甲基-2,4-己二烯
2-甲基-2,4-己二烯
(3)写出 4-甲基-2-庚烯的结构简式
CH3CH2CH2CH(CH3)CH=CHCH3
CH3CH2CH2CH(CH3)CH=CHCH3
(4)
 的分子式为
的分子式为C7H10O5
C7H10O5
(5)某烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烃的结构简式为
正戊烷
正戊烷
(6)写出 C7H8O属于芳香族化合物且能发生催化氧化反应,该物质的结构简式为:
苯甲醇
苯甲醇
(7)根据转化关系,在横线处写出三种物质的结构简式(要求:不同类别的物质).

(1)将20g Ba(OH)2?8H2O晶体与10g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻片上.用玻璃棒迅速搅拌,一会儿可发现水结冰并将玻片粘在烧杯上.
①实验中玻璃棒的作用是
②写出有关反应的化学方程式
③通过
(2)下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
①该金属与稀硫酸进行的反应属于
A.放热反应 B.复分解反应 C.氧化还原反应 D.离子反应 E.置换反应
②实验1、2可得出的结论是
③如果将实验用的金属丝先浸入硫酸铜溶液一段时间后,再取出进行上述实验4,则反应需要的时间应
④若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡.该金属的金属活动性比铁
查看习题详情和答案>>
①实验中玻璃棒的作用是
搅拌、混合反应物,促进反应进行
搅拌、混合反应物,促进反应进行
.②写出有关反应的化学方程式
Ba(OH)2?8H2O+2NH4Cl=2NH3↑+BaCl2+10H2O
Ba(OH)2?8H2O+2NH4Cl=2NH3↑+BaCl2+10H2O
.③通过
水结冰使玻片与烧杯粘在一起
水结冰使玻片与烧杯粘在一起
现象,说明该反应为吸热
吸热
(填“吸热”或“放热”)反应;这是由于反应物的总能量小于
小于
(填“小于”或“大于”)生成物的总能量.(2)下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
①该金属与稀硫酸进行的反应属于
ACDE
ACDE
A.放热反应 B.复分解反应 C.氧化还原反应 D.离子反应 E.置换反应
②实验1、2可得出的结论是
反应物浓度越大,反应速率越快
反应物浓度越大,反应速率越快
;实验3、4可得出的结论是反应温度越高,反应速率越快
反应温度越高,反应速率越快
.③如果将实验用的金属丝先浸入硫酸铜溶液一段时间后,再取出进行上述实验4,则反应需要的时间应
<
<
(填“>”或“<”)50s,你认为比较合理的解释是:金属与置换出的铜构成原电池,加快了反应速率
金属与置换出的铜构成原电池,加快了反应速率
.④若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡.该金属的金属活动性比铁
强
强
(选填“强”或“弱”),铁在该原电池中作正
正
极.