网址:http://m.1010jiajiao.com/timu3_id_155198[举报]
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s) NH3(g) + HI(g)?????? b.2HI(g)
NH3(g) + HI(g)?????? b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式??????????????????
②达到平衡后,扩大容器体积,反应b的移动方向?????? (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化?????? (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)? ΔH=-92.60 kJ·mol-1
2NH3(g)? ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
???????????????? 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因????????????????????????
查看习题详情和答案>>
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)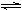 NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g) 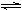 H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 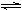 2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因 查看习题详情和答案>>
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)
 NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因
(1)为测定某地空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定_________________。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助同学完成100 mL 5×10-4 mol·L-1碘溶液的配制:
第一步:准确称取1.27 g碘单质加入烧杯中,________________;
第二步:______________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。

(2)乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4mol·L-1的碘溶液,注入上图所示广口瓶中,加2—3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,抽气次数至少为_____次,方可说明该地空气中排放的SO2含量符合标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_____________________________________________________________________。
③丙同学认为:乙同学的实验方案抽气次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_______________________________________。
(3)改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用______________(选填a.浓硫酸 b.银氨溶液 c.新制的氢氧化铜 d.酸化的高锰酸钾溶液)。
查看习题详情和答案>>